اسید و باز و اختلالات آن، از پایهایترین قسمتهای متابولیسم بدن است که آشنایی با آن برای تمام پزشکان اهمیت دارد؛ زیرا که اختلالات اسید و باز، تقریباً روی تمام ارگانهای بدن اثر میگذارد. در اولین درس، به سراغ مفهوم pH و ارتباطش با میزان یون هیدروژن میرویم.
پی اچ که در فارسی با تلفظ پ هاش نیز رایج است، از مقادیری است که بدن موجود زنده به شدت روی آن حساس است و به دقت کنترلش میکند.
پیاچ در مورد یون +H (یون هیدروژن) یا همان پروتون است و تمام حرفهایی نیز که در ادامه آمده، در مورد +H است. اتم هیدروژن، با تمام شگفتیاش و میزان فراوانش در بدن انسان، موضوع بحث فعلی ما نیست.
اما اتم هیدروژن آنقدر ارزشمند است که قبل از شروع، حرف ادوارد رابرت هریسون، اخترشناس انگلیسی (۲۰۰۸-۱۹۱۹) را در موردش بخوانیم.

۱. در مورد غلظت یون هیدروژن در مایع خارج سلولی
هیچ وقت به غلظت یون هیدروژن در خونی که در رگهایمان است، فکر کردهای؟
در مورد غلظت یون سدیم زیاد صحبت میکنیم؛ همینطور یون پتاسیم. میدانیم که غلظت یون سدیم خون حدود ۱۳۵ تا ۱۴۵ میلیمول در لیتر است. اما غلظت یون پتاسیم خون خیلی کمتر است. غلظت آن حدود ۳/۵ تا ۵ میلیمول در لیتر است. اختلاف قابل توجهی وجود دارد.
اما در مورد یون هیدروژن چطور؟ آن را با یون سدیم مقایسه بکنیم: در خون، غلظت یون سدیم حدوداً ۳ میلیون تا ۳/۵ میلیون برابر غلظت یون هیدروژن است. غلظت یون هیدروژن، فقط و فقط ۴۰ نانومول در لیتر است، یعنی ۰/۰۰۰۰۰۰۰۴ مول در لیتر.
نسبت به سدیم و پتاسیم خیلی کم است. بدنمان، غلظت یون هیدروژن را حدوداً بین ۳۵ تا ۴۵ نانومول در لیتر حفظ میکند.
آن قدر غلظتش مهم است که اگر فقط حدود ۴ برابر بیشتر یا کمتر بشود، میمیریم. زندگیمان نمیتواند در غلظتهای یون هیدروژنِ کمتر از ۱۶ یا بیشتر از ۱۶۰ نانومول در لیتر، ادامه پیدا بکند.
برای این که درک بهتری از این موضوع داشته باشیم که چقدر مقدارش کم بوده و حفظ غلظت آن در این مقدار کم چه کار سختی است، فقط تصور کن که یک قاشق از اسید معده را به خون اضافه بکنیم. سپس کمی صبر کنیم که این یون اضافه شده، در مایع خارج سلولی پخش بشود. حال، اگر غلظت یون هیدروژن را اندازه بگیریم غلظت آن حدود ۳۰۰۰ برابر شده است.
آن را با یون سدیم مقایسه کنیم: اگر یک قاشق نمک بخوریم، فقط حدود ۷ میلیمول به غلظت حدوداً ۱۴۰ میلیمول در لیتری یوم سدیم اضافه میشود.
اما، هیچ کدام از این دو اتفاق نمیافتند. در مورد یون هیدروژن، سیستمهای دفاعی در بدن داریم که از تغییرات شدید غلظت یون هیدروژن جلوگیری کنند. در مورد یون سدیم نیز، کلیهها به دقت مقدار آن را کنترل میکنند.
۲. در مورد اهمیت غلظت یون هیدروژن
اکنون که این متن را مینویسم، هزاران هزار آنزیم در بدن من مشغول به کار هستند. حاصل کار آنها، زنده بودنِ منِ نویسندهی این متن است.
میدانیم که تقریباً تمام آنها، از جنس پروتئین بوده و آجرهای سازندهی این ساختمانهای پروتئینی از جنس اسیدهای آمینه هستند. در ساختار آنها، گروههای عاملی اسیدی و بازی وجود دارد.
اگر غلظت یون هیدروژن زیاد بشود، یون هیدروژن اضافی با این گروههای عاملی بازی واکنش نشان میدهد. اگر غلظت یون هیدروژن کم بشود، یون هیدروژن از گروههای اسیدی جدا شده و به محیط اضافه میشود.
این تغییراتی که در ساختار آنزیم اتفاق میافتد، باعث میشود که شکل سهبعدی آن تغییر بکند و دیگر نتواند به خوبی، عملکردش را انجام بدهد.
همچنین، تغییرات مشابهی بر روی مادهای که آنزیم بر آن مؤثر است، میتواند اتفاق افتد.
یعنی هم آنزیم تغییر میکند و هم سوبسترای آن.
نتیجهاش میشود قلبی که با قدرت نمیتپد، اعصابی که درست و به سرعت پیامها را انتقال نمیدهند، استخوانی که ساختارش تغییر میکند و …
نهایتاً، تا حدی بدن میتواند تحمل بکند. سپس میمیریم.
۳. در مورد راحتتر کار کردن با اعداد غلظت یون هیدروژن
غلظت یون هیدروژن کم است و کار کردن با این اعداد کوچک، دشوار و طاقتفرساست.
سوران سورانسن (S. P. L. Sørensen)، در مقالهی معروف سال ۱۹۰۹ خود، مفهومی به نام pH را معرفی کرد. قرار است با این مفهوم بتوانیم راحتتر با غلظت یون هیدروژن کار بکنیم. کارل هاسلبالخ (Karl Hasselbalch)، پزشک و شیمیدان دانمارکی، مفهوم pH را به زبان لگاریتم نوشت.
میخواهیم کار او را با هم مرور کنیم. میدانیم که در مایع خارج سلولی غلظت یون هیدروژن حدود ۴۰ نانومول است. برای تبدیل غلظت به pH کافی است که از آن لگاریتم در مبنای ده بگیریم. در ادامه این مراحل را بررسی میکنیم:
اول آن را به مول بنویسیم:
[H+] = 0.00000004 mol/L
سپس از دو طرف لگاریتم در مبنای ۱۰ میگیریم:
Log [H+] = Log 0.00000004
log [H+] = log (4 × 10-8) = log (4) + log (10-8) = log (4) – 8 log (10)
log [H+] = log (4) – 8
log [H+] = 0.6 – 0.8 = -7.4
Log [H+] = -7.4
چون دوست نداریم با اعداد منفی کار بکنیم، دو طرف معادله را در ۱- ضرب میکنیم:
-Log [H+] = 7.4
طبق قرارداد، عبارت سمت چپ معادله را pH یا Potential of Hydrogen (پتانسیل هیدروژن) یا Power of Hydrogen (قدرت هیدروژن) مینامیم. مشخص نیست که دقیقاً منظور سورانسن از حرف P چه بوده است و او به شکل واضحی در این مورد، روشنسازی نکرد. پس:
pH = 7.4
از این معادله متوجه میشویم که غلظت یون هیدروژن و pH، رابطهی معکوس دارند. عملاً پی اچ میزان یون هیدروژن اسیدی بودن یک محلول را نشانمان میدهد و از آنجایی که حتی مقادیر کم یون هیدروژن میتواند محلول را اسیدی بکند، از pH استفاده میکنیم تا بتوانم این اسیدیته را بهتر متوجه بشویم.
هر چقدر غلظت یون هیدروژن بیشتر باشد، pH کمتر است؛ زیرا که pH، منفی لگاریتم غلظت هیدروژن است.
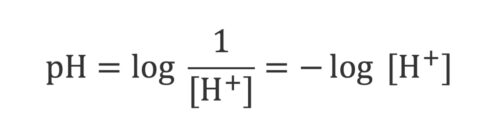

سورانسن در ابتدا میخواست پزشکی بخواند؛ اما تحت تأثیر سوفِس جورگانسِن، شیمیدان معروف دانمارکی، به شیمی روی آورد. حدود ۱۱۰ سال پیش، سورانسن هنگام کار روی آبجو (برای پاسخ به این سؤال که چگونه میتوان آبجو با بهترین کیفیت ممکن را ساخت)، مفهوم pH را ابداع کرد.
۳.۱. یادآوری مفهوم لگاریتم
جمع و تفریق با هم هستند و آنها را به هم تبدیل میکنیم. ضرب و تقسیم نیز همینطور.
۴ + ۵ = ۹
۴ = ۹ – ۵
۲۰ = ۴ × ۵
۵ = ۴ ÷ ۲۰
لگاریتم و توان نیز اینگونهاند. ده به توان سه هزار میشود و لگاریتم هزار در مبنای ۱۰ برابر ۳ است. منظور از لگاریتم عدد فرضی n در یک مبنا، یعنی اینکه مبنا را به توان چه عددی برسانیم، تا حاصل n بشود.
y = bx
logb(y) = x
۱۰۰۰ = ۱۰۳
Log۱۰(۱۰۰۰) = ۳
به لگاریتم در مبنای ۱۰، Common Logarithm یا لگاریتم رایج یا لگاریتم اعشاری میگوییم و به خاطر کاربرد فراوان و رایج بودن آن، عدد ۱۰ را در هنگام نوشتن لگاریتم در مبنای آن، نمینویسیم.
لگاریتم به وجود آمد تا محاسبات راحتتر گردد. به خاطر لگاریتم، کار با اعداد خیلی بزرگ یا خیلی کوچک، ملموستر و راحتتر میشود.
یادمان باشد که لگاریتم هر عدد در مبنای خودش، برابر با یک میشود.
۴. در مورد pH مایعات بدن
در سرخرگهای ما، pH برابر ۷/۴ است و در سیاهرگها و مایع میانبافتی برابر ۷/۳۵. دلیل کمتر بودن pH در سیاهرگها، غلظت بیشتر دیاکسید کربن در سیاهرگها و مایع میانبافتی است که پس از حل شدن در آب، تبدیل به کربنیک اسید شده و یون هیدروژن آزاد میکند. pH خون شریانی را pH خنثی در نظر میگیریم. پس Neutral pH یا pH فیزیولوژیک یا pH خنثی عدد ۷/۴ در بدنمان ۷/۴ است. اینجا، اختلاف شیمی و فیزیولوژی است. در شیمی، pH خنثی عدد ۷ است.
همچنین درون سلول، کمی اسیدیتر از خارج سلول است و دلیل آن، تولید اسیدهای مختلف به علت متابولیسم است. گلوکز میسوزد و دی اکسید کربن تولید میگردد و با آب واکنش میدهد و کربنیک اسید تولید میشود. البته که اسیدهای دیگری نیز تولید میگردند.
pH ادرار بستگی به وضعیت اسیدی بودن یا بازی بودن بدن دارد. محدودهی آن در حدود ۴/۵ تا ۸ است و بعداً در مورد نقش مهم کلیهها برای تنظیم pH بدن، صحبت میکنیم.
درست است که بدن انسان یک محدودهای از یون هیدروژن را میتواند تحمل بکند و کمتر یا بیشتر از آن کشنده است؛ اما استثناهایی نیز در این مورد وجود دارد.
در سلولهای Parietal معدهی ما، غلظت یون هیدروژن حدود ۴ میلیون برابر بیشتر از خون است و pH میتواند به ۰/۸ برسد.
اما به شکل کلی یادمان باشد که اگر بخواهیم غلظتی از هیدروژن را که بدن میتواند تحمل بکند، یعنی از ۱۶ تا ۱۶۰ نانومول در لیتر را به pH تبدیل بکنیم، به محدودهی ۶/۸ تا ۷/۸ میرسیم.
در درس بعدی به تعریف اسید و تعریف باز خواهیم پرداخت و سپس میبینیم که بدن چطور pH را در محدودهی قابل حیات حفظ میکند.
پیام درس
غلظت یون هیدروژن در بدن انسان، نسبت به سایر یونها بسیار کم است (در حدود ۴۰ نانومول در لیتر). برای جلوگیری از سختی کار با اعداد کوچک، از مفهوم pH استفاده میکنیم. pH، منفی لگاریتم غلظت یون هیدروژن است.
pH خنثی در بدن انسان ۷/۴ در نظر گرفته میشود. محدودهای که به طور نرمال pH تغییر میکند، بسیار کوچک بوده و حدود ۷/۳۵ تا ۷/۴۵ است. انسان نمیتواند pHهای کمتر از ۶/۸ یا بیشتر از ۷/۸ را تحمل بکند و میمیرد. دلیل آن، عوض شدن ساختار سه بعدی آنزیمها است.
برای امتیاز دهی به این مطلب، لطفا وارد شوید: برای ورود کلیک کنید




سلام آقای دکتر، مدرسه پزشکی یکی از بهترین قسمت های وبلاگ تونه و واقعا مفیده. خیلی ممنون از شما