اکی والان (Equivalent) را زیاد شنیدهایم. میگوییم غلظت یون پتاسیم سرم ۴ میلی اکی والان در لیتر، غلظت یون سدیم سرم ۱۴۰ mEq/L و غلظت یون هیدروژن ۴۰ nEq/L است.
اما میبینیم که جایی دیگر میگویند غلظت یون پتاسیم ۴ میلی مول در لیتر است. سدیم نیز ۱۴۰ میلی مول در لیتر.
ولی وقتی نوبت به غلظت یون منیزیم میرسد، حدود ۲ میلیگرم در دسیلیتر، یک میلیمول در لیتر یا ۲ mEq/L است.
این لحظه است که سردرگمی پیش میآید.
غلظت یونها به سه شکل در خون گزارش میشود:
- با واحد mg/dL که برای یونهایی مثل کلسیم و منیزیم رایج است. مثلاً میگوییم غلظت طبیعی کلسیم در خون حدود ۸/۵ تا ۱۰/۵ میلی گرم در دسی لیتر است.
- با واحد mmol/L یا میلی مول در لیتر
- با واحد mEq/L یا میلی اکی والان در لیتر
این قابل درک است که بخواهیم میلی گرم را به میلی مول تبدیل کنیم. اما سومی چرا؟ mEq/L چیست؟
اکی والان یعنی چه؟
فرض کنیم که یک مول هیدروکلریک اسید داریم. یک مول HCl در صورت تفکیک کامل، میتواند یک مول یون هیدروژن تولید بکند:
HCl ⇌ H+ + Cl–
یک اکی والان از یک ماده، یعنی مقداری از ماده که بتواند یک مول یون هیدروژن تولید بکند (یا اگر یک باز است، با یک مول یون هیدروژن واکنش بدهد).
پس یک مول HCl برابر با یک اکی والان HCl است.
تا اینجای کار که همانند قبل است و چیزی تغییر نکرده است.
تفاوت اکی والان و مول یک ماده
سولفوریک اسید را در نظر بگیریم. H2SO4 طبق معادلهی زیر تفکیک میشود:
H2SO4 ⇌ H+ + HSO4– ⇌ H+ + SO42-
میبینیم که یک مول سولفوریک اسید، بر خلاف یک مول HCl، در صورت تفکیک کامل، میتواند دو مول یون هیدروژن تولید بکند. پس:
1 mol H2SO4 = 2 Equivalents H2SO4
و حتماً در مورد فسفریک اسید که فرمولش H3PO4 است، میتوانید حدس بزنید که یک مول فسفریک اسید، برابر با ۳ اکیوالان از آن است.
پس در مورد اسیدهای چند ظرفیتی، اکی والان و مول متفاوت خواهد بود.
تعریف بر اساس هیدروژن و الکترون
وقتی از یک اکیوالان از یک ماده صحبت میکنیم، معنایش این است که:
۱) آن ماده میتواند در یک واکنش اسید و باز، یک مول یون هیدروژن تولید بکند یا یک مول یون هیدروژن را بپذیرد.
۲) آن ماده میتواند در یک واکنش اکسایش-کاهش (Redox)، با یک مول الکترون واکنش بدهد یا یک مول الکترون تأمین بکند.
برای درک دومین تعریفش، به تفاوت کلسیم و سدیم توجه کنیم. اگر هر دو بخواهند با کلر ترکیب بشوند:
1 mol Ca + 2 mol Cl → 1 mol CaCl2
1 mol Na + 1 mol Cl → 1 mol NaCl
میبینیم که یک مول کلسیم به علت تعداد الکترونهای لایهی آخرش، میتواند با دو مول کلر واکنش بدهد؛ زیرا که میتواند دو مول الکترون تأمین بکند.
در شکل زیر، به تعداد الکترونهای لایهی آخر توجه کنیم. کلسیم دو الکترون در لایهی آخر دارد. تعداد الکترونهایی که یک اتم برای یک معامله میتواند وسط بگذارد یا دریافت بکند، اکیوالان آن را مشخص میکند.
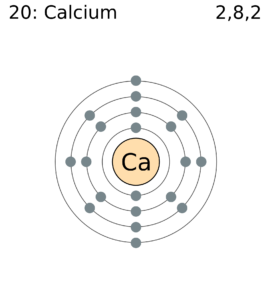
واژهی اکی والان (equivalnet) به معنای equal in value هست (+). یعنی مثلاً یک مول از این سولفوریک اسید با چه مقداری از سدیم هیدروکسید برابر است؟ در پاسخ به این سؤال این واحد شکل گرفت.
اکی والان به ظرفیت (والانس) ربط دارد – یعنی تعداد الکترونهایی که یک اتم میتواند در هنگام یک واکنش شیمیایی، از دست بدهد، به دست بیاورد یا اینکه به اشتراک بگذارد.
پس یک مول سدیم، برابر با یک اکی والان سدیم و یک مول کلسیم، برابر با دو اکی والان کلسیم است.
تبدیل مول و اکی والان به همدیگر
تبدیل مول به اکی والان، کار سختی نیست. اگر تعداد مولهایی را که از ماده داریم در تعداد الکترونهایی که میتواند به دست آورده یا از دست بدهد ضرب کنیم، اکی والان به دست میآید.
مثلاً اگر یک مول پتاسیم کلراید داشته باشیم (KCl) و آن را در آب حل کنیم، در صورت تفکیک کامل یک مول یون پتاسیم و یک مول یون کلراید خواهیم داشت.
چون ظرفیت هر دوی آنها برابر با یک است، در نتیجه میتوانیم بگوییم که یک اکی والان یون پتاسیم و یک اکی والان یون کلراید داریم.
حال اگر به محلول فوق، یک مول کلسیم کلراید نیز اضافه بکنیم (CaCl2)، حاصل نهایی آن، یک اکی والان یون پتاسیم، دو اکی والان یون کلسیم و سه اکی والان یون کلراید خواهد بود. حساب و کتابش با خودتان.
پیام درس
معمولاً در واکنشهای اسید و باز ترجیح میدهیم به جای مول، از اکی والان استفاده کنیم. این دو برای اسیدهای یک ظرفیتی، برابر است. اما در اسیدهای چند ظرفیتی، استفاده از مول گمراهکننده خواهد بود.
مثلاً یک مول سولفوریک اسید – یک اسید دو ظرفیتی – در صورت تفکیک کامل دو مول یون هیدروژن تولید میکند و با دو مول سدیم هیدروکسید میتواند واکنش دهد. در صورتی که یک مول هیدورکلریک اسید با یک مول سدیم هیدروکسید.
برای رفع این مشکل، از واحد اکی والان استفاده میکنیم. در واکنش اسید و باز، یک اکی والان از یک ماده، یعنی مقداری از ماده که بتواند یک مول یون هیدروژن تولید بکند (یا اگر یک باز است، با یک مول یون هیدروژن واکنش بدهد).
برای امتیاز دهی به این مطلب، لطفا وارد شوید: برای ورود کلیک کنید




