مسیری پرتلاطم و طولانی، از اولین سلول در اعماق آبها تا به انسان طی شده است.
برای اینکه سلولها بتوانند کارشان را به درستی انجام دهند، باید در محیط مساعدی باشند. این محیط که فضای خارج سلولی (extra-cellular space) نام دارد، سلولها را در بر گرفته و حاوی مایع خارج سلولی (extra-cellular fluid) است.
سلولهای ما و بسیاری دیگر از جانوران، به غلظت یونها، دما، میزان اسیدی بودن و تونیسیته (tonicity) و برخی دیگر از متغیرها در مایع خارج سلولی آنقدر حساس هستند که این موارد تحت کنترل سریع و دقیق قرار گرفتهاند.

تعریف تونیسیته
تونیسیته یعنی یک محلول چه اثری بر روی حجم سلول دارد: باعث تورم سلول میشود (hypotonic) یا چروکیدگی آن (hypertonic)؟ یا اینکه روی حجم سلول اثری ندارد (isotonic)؟
آنچه که باعث تغییر حجم سلولها میشود، ورود یا خروج آب است.
به بیان دیگر، تونیسیته، تعیینکنندهی جابهجایی آب بین سلول و خارج آن است.
چه چیزی تونیسیته را تعیین میکند؟ همانطور که در درس فشار اسمزی خواندهایم، اسمز هست که منجر به جابهجایی آب میشود. به عبارت دیگر، ذرهای باید باشد که باعث کاهش حرکات رندوم مولکولهای آب در یک سمت شده و در نتیجه، جابهجایی آب داشته باشیم.
پس تعیینکنندهی تونیسیته، ذرات حلشده در آب هستند.
هرگاه از تعداد ذرات حلشده صحبت کنیم، باید از مول و اسمول نیز بگوییم.
تعریف مولاریته و تفاوت مولاریته و اسمولاریته
در شیمی برای سنجیدن و مقایسه غلظت یونها از مولاریته (molarity) یا همان غلظت مولار (molar concentration) استفاده میشود. به میزان ذرهی حل شده (با واحد مول) در یک محلول مولاریته میگویند.
رایجترین واحدی که برای مولاریته استفاده میشود، مول در لیتر (mol/L) است. این واحد را با M یا M نیز نشان میدهند. مثلاً محلول glucose 1 M، یعنی در یک لیتر، یک مول گلوکز حل شده است.
برای نشان دادن مولاریته از براکت [ ] نیز استفاده میشود. مثلاً برای مولاریته یون سدیم، از [+Na] استفاده میکنیم.
تا همین لحظه احتمالاً برای شما نیز این سؤال شکل گرفته که حل شدن گلوکز با حل شدن سدیم کلراید تفاوت دارد. سدیم کلراید تفکیک نیز میشود.
و از آنجایی که آنچه باعث جابهجایی آب میشود، تعداد کل ذرات موجود در یک محلول هستند، ترجیح میدهیم که در هنگام صحبت از انسان و دیگر موجودات، به جای استفاده از مولاریته، از واحد دیگری استفاده کنیم که تفکیک را نیز در نظر بگیرد.
مثلاً یک مول سدیم کلراید، در صورت تفکیک کامل، دو مول ذره در محلول ایجاد میکند: یک مول یون سدیم و یک مول یون کلراید.
برای جابهجایی آب، تعداد ذرات حلشده مهم است. اندازهی آنها و بار آنها مهم نیست. مهم این است که چه تعداد ذره وجود دارد.
اسمولاریته (osmolarity)، بر خلاف مولاریته، تفکیک مواد در محیط آبی را هم در نظر میگیرد. پس وقتی از اسمولاریته استفاده میکنیم، یعنی چه تعداد ذره در یک لیتر از این محلول قرار دارند.
در حالت ایدهآل و با در نظر گرفتن تفکیک یونی کامل، اگر یک میلیمول سدیم کلراید در یک لیتر آب حل کنیم، با تفکیک آن به یک میلیمول یون سدیم و یک ملیمول یون کلراید، اسمولاریته آن دو میلیمول/لیتر خواهد بود. به این حالت، “theoretical osmolarity” میگویند (+).
اسمولاریته تئوریک وقتی است که تفکیک یونی را به شکل کامل در نظر میگیریم (یعنی ضریب وانت هوف دو برای سدیم کلراید).
وانت هوف (Van’t Hoff)، برندهی نخستین نوبل در شیمی بود. ضریب وانت هوف به این اشاره میکند که غلظت یک ماده در یک حلال، چگونه خواهد شد؟ برای موادی که تفکیکپذیر نیستند، ضریب وانتهوف برابر با یک خواهد بود (مثلاً گلوکز). اما برای موادی که به یونهای سازنده تفکیک میشوند، بزرگتر از یک است.

فاکتور یا ضریب وانت هوف از تقسیم تعداد ذرات موجود در یک محلول بر تعداد مول اولیهی ماده، به دست میآید.
مثلاً اگر یک مول سدیم کلراید داشته باشیم، در صورت تفکیک کامل، دو مول ذره ایجاد میکند. در این صورت ضریب وانت هوف برابر با ۲ خواهد بود.
پس، ضریب وانت هوف، مولاریته و اسمولاریته را به هم مربوط میکند.
Osmolarity = i × Molarity
i = van’t Hoff factor
دقت کنیم که ما تاکنون یک سادهسازی مهم انجام دادهایم. برای همین بارها بر عبارت تفکیک کامل تأکید کردیم. در شرایط واقعی، تفکیک کامل نداریم. مثلاً برای یک محلول سدیم کلراید، تعدادی از یونهای سدیم و کلراید در لحظه به هم متصل (ion association) و سپس دوباره جدا میشوند. در هنگام اتصال آن دو ذره، دوباره یک ذره محسوب میشوند. این موضوع را بعداً بیشتر توضیح خواهیم داد.

ایراد مولاریته و اسمولاریته
اگر این محلول را گرم یا سرد کنیم، تعداد ذرات حلشده تغییری نخواهد کرد؛ اما حجم محلول عوض میشود. پس به واحدی نیاز داریم که در مورد حلکننده دقیقتر اظهار نظر بکند.
شاید همین الان این ایراد را بگیرید مگر دمای بدن یک موجود خونگرم چقدر تغییر میکند؟
حرفتان درست است. اما ما نیز برای ایراد گرفتن به اسمولاریته، یک دلیل مهمتر داریم.
در بدن ما، یک لیتر از یک مایع، لزوماً یک لیتر از حلکننده را در بر ندارد. مثلاً در یک لیتر پلاسما، حدود ۷۰ میلیلیتر پروتئین و لیپید وجود دارد. پروتئین و لیپید نیستند که سدیم کلراید را در خود حل کردهاند. آن ۹۳۰ میلیلیتر آب باقیمانده در این محلول است.
پس به واحدی نیاز داریم که دغدغهی اصلیاش، میزان دقیق حلکننده باشد – نه حجم کلی محلول.
اگر که حلال من فقط از آب تشکیل میشد، تنها تفاوت اسمولالیته و اسمولاریته، حجم محلول بود که وابسته به دما میشد. اما در بدن موجودات، حلال فقط از آب تشکیل نشده است و در هر حلال، میزان قابل توجهی جزء غیر آبی (لیپید و پروتئین) وجود دارد که در حل کردن نقشی ندارند.
به خاطر این دغدغه بود که مولالیته و اسمولالیته شکل گرفت.
تعریف مولالیته و اسمولالیته
وقتی از مولالیته (molality) و اسمولالیته (osmolality) (با ل) صحبت میکنیم، میزان حلال حتماً یک کیلوگرم است. در محیط بدن، این حلال آب است.
تفاوت مولالیته و اسمولالیته نیز، مثل تفاوت مولاریته و اسمولاریته است. وقتی بحث اسمول میشود، تفکیک در محیط آبی نیز در نظر گرفته میشود.
محلول یک مولال گلوکز، یعنی یک مول گلوکز در یک کیلوگرم آب. اما در مورد سدیم کلراید که تفکیک میشود، بهتر است از اسمولالیته استفاده کنیم.
یک مول سدیم کلراید در یک کیلوگرم آب، اسمولالیته برابر با ۲ اسمول در کیلوگرم خواهد داشت.
همانطور که گفته شد، اسمولالیته دو برتری نسبت به اسمولاریته دارد:
- جرم (مولالیته و اسمولالیته) به دما وابسته نیست؛ اما حجم (مولاریته و اسمولاریته) به دما وابسته است. بنابراین اسمولالیته و مولالیته، برخلاف اسمولاریته و مولاریته، تحت تأثیر دما قرار نمیگیرند.
- در اسمولالیته و مولالیته، میزان واقعی حلال مورد توجه قرار میگیرد.
در شیمی بالینی و داروسازی، محلولها معمولاً در محیط آبی ساخته میشوند. این با بدن انسان متفاوت است. پلاسما حاوی پروتئین و لیپید بوده و در حالت طبیعی، حدود ٪۷ از پلاسما را پروتئین و لیپید تشکیل داده که به آن بخش غیر آبی پلاسما (non-aqueous) میگویند (+).

به بیان دیگر، وقتی میگوییم غلظت سدیم حدود ۱۴۰ میلیمول در لیتر است، یعنی میزان سدیم در یک لیتر پلاسمایی که ۷ درصد آن پروتئین و لیپید بود، ۱۴۰ میلیمول/لیتر است. این سدیم که در پروتئین و لیپید حل نمیشود؛ بلکه در آن ۹۳ درصد باقیمانده که آب است، حل میشود.
عبارت دقیقتر این میشود: غلظت سدیم در یک لیتر پلاسما که ۹۳۰ میلیلیتر آب دارد، ۱۴۰ میلیمول است. پس وقتی میگوییم غلظت سدیم ۱۴۰ میلیمول در لیتر است، این لیتر، هم به بخش آبی و هم به بخش غیر آبی پلاسما اشاره دارد.
پس دیگر اینجا نمیتوانم بگویم یک لیتر از حلکنندهی من، تقریباً یک کیلوگرم حلکننده نیز دارد. به خاطر جزء غیر آبی در پلاسما، اسمولالیته و اسمولاریته آن تفاوت محسوس دارد.
این مسئله، مهمترین علتی است که ترجیح میدهیم از اسمولالیته استفاده کنیم.
شباهت این دو مفهوم نیز در این است که چه برای اسمولالیته و چه برای اسمولاریته، تعداد ذرات مهم است.
پس ببینیم در هر کدام از فضاهای داخل و خارج سلول چه ذراتی وجود دارند.
مقایسه ترکیب فضای داخل و خارج سلول
ترکیبات داخل و خارج سلول را با این شکل کتاب نلسون، به خوبی میتوان مقایسه کرد:
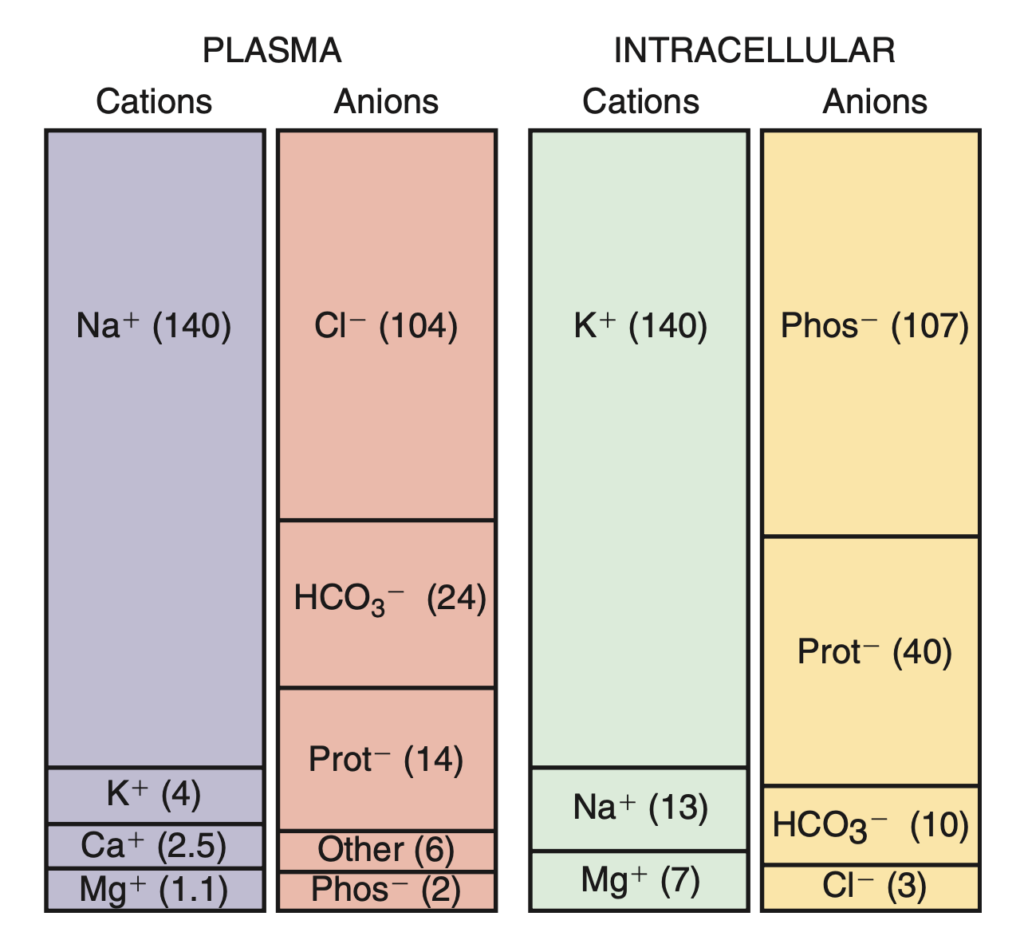
به این نمودارها، gamblogram میگویند. گمبلوگرام به افتخار جیمز گمبل (James Gamble) نامگذاری شده است (+).
گمبل از این نمودارها برای نشان دادن مفهوم electroneutrality در اسید و باز استفاده کرد. مفهومی که برای داخل و خارج سلول صادق است: مجموع بار کاتیونها و آنیونهای داخل هر کدام از فضاها برابر است و از لحاظ الکتریکی، چه داخل و چه خارج سلول، و چه کل بدن ما، باردار نیست.

همانطور که در شکل بالا میبینید، کاتیون اصلی داخل سلولی، پتاسیم و کاتیون اصلی خارج سلولی سدیم است. علت تفاوت کاتیونهای داخل و خارج سلول، وجود پمپ سدیم – پتاسیم است که با مصرف انرژی، پتاسیم را در داخل سلول و سدیم را در خارج آن نگه میدارد.
آنیونهای اصلی داخل سلول پروتئینها و آنیونهای مختلف حاوی فسفر است و آنیون اصلی خارج سلول بیکربنات و کلراید است.
علت اصلی تفاوت آنیونهای داخل و خارج سلول، محدود بودن پروتئینها و آنیونهای حاوی فسفر به داخل سلول است. روشی برای خروج آنها، در اختیار نیست.
اما تعداد ذرات حلشده در این دو فضا، یکسان نیست. به همین خاطر، برای این که از لحاظ غلظت به یک مقدار برسند، فضای داخل سلولی، حاوی آب بیشتری است.
دقت کنیم که در دوران جنینی و تا حدود یک سالگی، فضای خارج سلولی از فضای داخل سلولی آب بیشتری دارد و از یک سالگی، این نسبت همانند بزرگسالان میشود.
اما آیا هر اسمولی که در سلول یا خارج سلول وجود دارد، در تونیسیته نیز اثر دارد؟ خیر. اینجاست که مفهوم اسمول و اسمولالیته مؤثر (effective osmolality) شکل میگیرد.
مفهوم Effective Osmolality
اگر بدن را یک ظرف آب بزرگ در نظر بگیریم، میتوانیم آن را به کمک غشای سلولها به دو قسمت داخل و خارج سلول تقسیم کنیم. بعضی از اسمولها فقط در داخل یا خارج سلول وجود دارند. برخی به راحتی جابهجا میشوند و در هر دو فضا وجود دارند.
به ذراتی که به یک فضا محدود هستند، effective osmole (اسمول مؤثر [در تونیسیته]) میگویند. این ذرات هستند که به روی تونیسیته اثر میگذارند.
آیا ممکن است ذرهای داشته باشیم و به یک فضا محدود نباشد و در نتیجه باعث جابهجایی آب نشود؟ اوره و الکلها (متانول، اتانول و اتیلنگلیکول) چنین ذراتی هستند.
اگر به بدن الکل یا اوره اضافه کنیم، به راحتی – البته از طریق کانالهایی همیشه باز – از غشاها عبور کرده و پس از مدتی غلظتشان در داخل و خارج سلول برابر میشود (با فرض اینکه در این مدت در داخل سلول متابولیزه نمیشوند). در نتیجه اثرشان به روی محدود کردن حرکت مولکولهای آب در دو طرف به یک اندازه است و منجر به جابهجایی خالص آب نخواهند شد.
به الکل و اوره، ineffective osmole (اسمولهای غیر مؤثر [در تونیسیته]) میگویند.
پس، تونیسیته مایع خارج سلولی، وابسته به اسمولهای مؤثرِ حلشده در آن است.
از آنجایی که بیشترین ذرهی خارج سلولی، سدیم و آنیونهای همراهش است، مهمترین عامل تعیینکننده تونیسیته، غلظت سدیم و آنیونهای همراه سدیم خواهد بود. غلظت آنها معمولاً متناسب با هم تغییر میکند. اگرچه شرایطی مثل استفراغ وجود دارد که مشکل اصلی، کاهش یکی از این دو است.
اثر سدیم بر تونیسیته
اهمیت سدیم در تعیین تونیسیته مایع خارج سلولی است. تغییرات سدیم، منجر به تغییر تونیستیه و متعاقباً، تغییر حجم سلول میشود.
تعریف تونیسیته را یادمان نرود: اثری که یک محلول بر حجم سلول دارد.
حالا میتوانیم این تعریف را دقیقتر بگوییم: اثری که یک محلول به واسطهی اسمولهای مؤثر بر حجم یک سلول دارد.
حالا چرا اینقدر بدن در مورد تونیسیته حساس است؟
شاید برای یک سلول ماهیچهای، بزرگ شدن موقت اندازهاش چندان دردسرساز نباشد؛ اما نورونهای موجود در فضای سخت جمجمه، جای چندانی برای بزرگ شدن ندارند.
پس، تغییرات سدیم منجر به تغییر اندازهی نورونها شده و به همین دلیل در اختلالات سدیم، طیفی از عوارض نورولوژیک را خواهیم داشت.
بنابراین بدن تلاش میکند که تونیسیته – نه لزوماً غلظت سدیم و اسمولالیته – را در محدودهی مجاز حفظ بکند تا از آسیب به سلولهای جلوگیری کند.
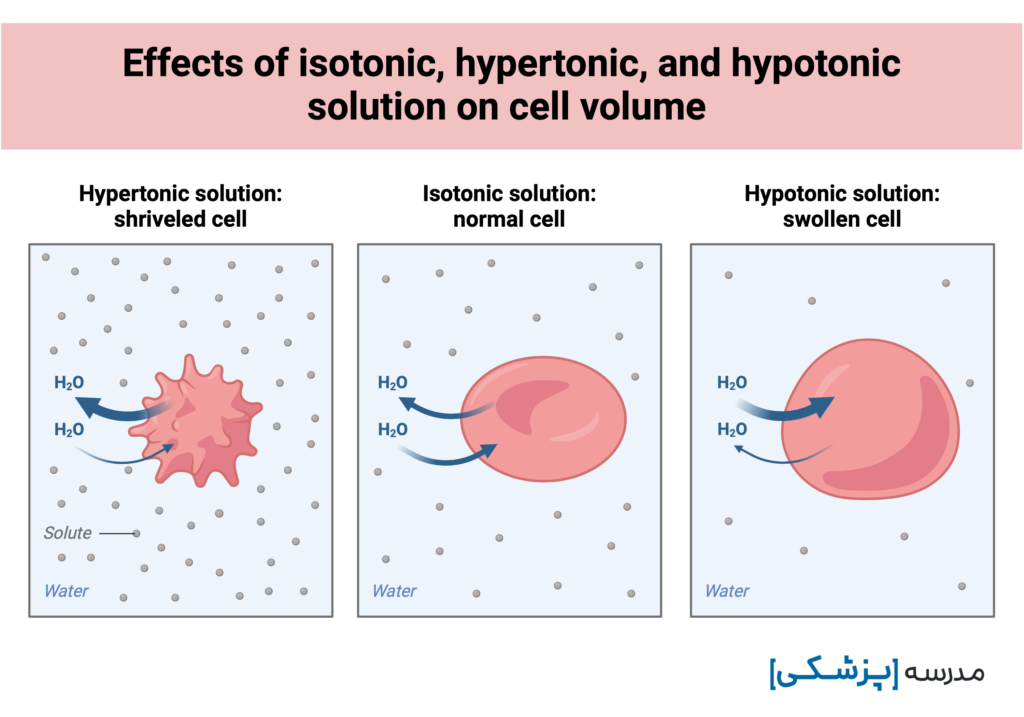
شاید با خود بگویید که چرا اینقدر به مباحث پایه برگشتهایم؟ عمیقاً معتقدیم که بدون درک این مباحث، در تفسیر اختلالات سدیم گیر خواهیم کرد. مثلاً به این سؤال فکر کنید که چرا نرمال سالین با وجود سدیم ۱۵۴ میلیمول در یک لیتر، یک محلول ایزوتونیک است و باعث تغییر حجم سلول نمیشود؟ با اینکه میدانیم محدوده طبیعی سدیم بدن، ۱۳۵ تا ۱۴۵ میلیمول در لیتر است.
پاسخ این سؤال را در درسهای بعدی متوجه میشویم.
پیام درس
درک اختلالات سدیم، از به کار بردن صحیح و دقیق واژههایی شروع میشود که مرتبط با آن هستند:
- مولاریته و مولالیته
- اسمولاریته و اسمولالیته
- تونیسته و اسمولالیته مؤثر
دغدغهی اصلی، تونیسیته است؛ تونیسیته یعنی یک محلول چه اثری بر تغییر حجم سلول میگذارد.
اینکه محلول اثر بگذارد یا نه، به ذرات داخل آن بستگی دارد. اگر ذراتش از غشای سلول عبور نکنند و فقط در فضای خارج سلولی باقی بمانند، اثر میگذارد.
پس برای درک بهتر تونیسیته، ذرات یک محلول را باید بشناسیم.
برای شناختن ذرات، از مولاریته شروع میکنیم. مولاریته یعنی چند مول از آن ماده در یک لیتر محلول وجود دارد. از اینجا به بعد، حلالمان را کلاً آب در نظر میگیریم.
اشکال مولاریته در این بود که تفکیک نمکها را در نظر نمیگرفت. یک مول گلوکز با یک مول سدیم کلراید در محیط آبی، رفتار متفاوتی دارد. دومی، در صورت تفکیک کامل، به یک مول سدیم و یک مول کلراید تفکیک میشود.
پس به جای مولاریته، به سراغ اسمولاریته رفتیم.
اسمولاریته نیز یک ایراد بزرگ داشت. اسمولاریته، تعداد اسمولها در یک لیتر از محلول را محاسبه میکرد. اسمولاریته نمیگوید در یک لیتر محلول من، چقدر حلال وجود دارد.
مثلاً در مورد سدیم و دیگر الکترولیتها، محلول من پلاسما است. اما در یک لیتر پلاسما، یک لیتر حلال وجود ندارد. در هر لیتر پلاسما، ۹۳۰ میلیلیتر آب (حلال) و ۷۰ میلیلیتر چربی و پروتئین وجود دارد.
پس به واحد دیگری نیاز داشتیم که دغدغهاش میزان دقیق حلال باشد. در اینجا بود که مولالیته و اسمولالیته شکل گرفتند. در این دو واحد، تعداد مول یا اسمول (در صورت تفکیک شدن) در یک کیلوگرم حلال مهم است.
حالا اگر این اسمولها فقط به یک سمت (داخل یا خارج سلول) محدود باشند، اسمول مؤثر بر تونیسیته بوده و روی تغییر حجم سلول، مؤثر هستند.
ترتیبی که مدرسه پزشکی برای مطالعهی درسهای این مجموعه پیشنهاد میدهد، به صورت زیر است:
برای امتیاز دهی به این مطلب، لطفا وارد شوید: برای ورود کلیک کنید





چون در واقع اون غلظت مال کل پلاسماس ولی خب پلاسما دو بخش داشت ۹۳ درصد بخش حلال و هفت درصد پروتئین و لیپید داریم و اون غلظت که میگه ۱۳۴ میلی مول در لیتر شامل اسمولاریته کل پلاسما است و ما باید در واقع غلظت سدیم تو بخش حلال پلاسما رو بدست بیاریم که میشه
X * .93 = 144
X= 154
پس در واقعیت اسمولالیته نرمال سالین و پلاسما برابره
سوالم شاید یکم بیربط به موضوع اصلی باشه.
ولی اونجا که بحث electroneutrality مطرح شد، چطور اختلاف پتانسیل بین دو سوی غشا توجیه میشه؟ وقتی هیچ اختلاف باری نباشه اصولا نباید اختلاف پتانسیلی هم باشه!
سلام مهدی جان.
این سؤال بسیار خوبیه که تو بهش فکر کردی.
به بهانهی کامنت تو یه موضوعی رو مطرح کنم.
من هر وقت که در کلاسی درس میدم، یه چیزی که خیلی اذیتم میکنه، «بیسؤالی» هست. نه اینکه هر چیزی رو که به ذهن میاد، دانشآموز یا دانشجو بگه. اما وقتی در جای درستش، سؤال درست مطرح میشه، باعث خوشحالی هست.
فعلاً بگم که electroneutrality و membrane potential با هم ناسازگاری ندارند. من حتماً این رو یادداشت میکنم که در درسهای پتانسیل غشا که فعلاً یکیش رو نوشتیم (همون درس پمپ سدیم – پتاسیم)، توضیح بدیم.