تاکنون از یون هیدروژن و اسید و باز گفتهایم. این بار، مکانیسمهای دفاعی را بررسی خواهیم کرد. یعنی اگر یک اختلال اسید و باز به وجود آید، موجود زنده برای مقابله با آن چه میکند؟
اولین کار استفاده از سیستم بافری است. به عبارتی، باید به این سؤال پاسخ دهیم که اگر یک سیستم حاوی بافر باشد، هنگام اضافه شدن اسید یا باز، pH چه میشود و محاسبه pH محلول بافر چگونه خواهد بود؟ برای این کار به سراغ استفاده از معادله هندرسون هاسلبالخ میرویم.
۱. جلوگیری از تغییرات یون هیدروژن
فرض کنیم دانشمندی وجود دارد که آزمایشهای عجیبی انجام میدهد. از آن زیرزمینهای پنهان دارد. در آنجا انسانی را زندانی کرده است. دانشمند دیوانهی ما، عاشق اسید و باز است. میخواهد بر روی این انسان نیز آزمایشی مرتبط با اسید و باز انجام بدهد.
برای اینکه آزمایشش دقیق باشد یک مرد جوان سالم ۷۰ کیلوگرمی را انتخاب کرده است.
لبخندی مرموزانه به جوان میزند، به او نزدیک میشود. دستان جوان بسته است اما هنوز کمی تقلا میکند. دانشمند ۱۰۰ میلی اکیوالان از HCl را به زور به او تزریق میکند.
او کنجکاو است. زیادی کنجکاو. میخواهد بداند که چه میشود؟
میدانیم که حدود ۶۰ درصد وزن بدن یک مرد جوان را آب تشکیل داده و از این ۶۰ درصد، حدود یک سوم آن در مایع خارج سلولی است. پس این اسید تزریقی در حدود ۱۴ لیتر آب پخش میگردد. برای اطمینان، قبل از تزریق نیز pH خون را اندازه میگیرد که دقیقاً ۷/۴۰ بوده است.
او همین مقدار اسید را به ۱۴ کیلوگرم آب تقریباً خالص نیز که pH اش ۷/۴۰ است، اضافه میکند. لحظهای بعد pH آب را اندازه میگیرد. با کمی محاسبه نیز، خودش قبل از اندازهگیری به عدد ۲/۱۵ رسیده بود. اندازهگیری نیز عدد محاسبه را تأیید میکند.
مشتاقانه به انسان زندانی نگاه میکند. منتظر است ببیند که چه اتفاقی خواهد افتاد. به سراغ انسان میرود. هنوز نفس میکشد و زنده است.
چرا چیزی نشد؟ نباید میمرد؟
قطرهای از خونش را میگیرد و pH را اندازهگیری میکند. فکر میکنی با چه عددی روبهرو میشود؟
تنها کمی کمتر شده است. حتی از ۷ نیز کمتر نگشته است. ناامید میشود و خشمگین. چرا اینقدر کم تغییر کرده است؟
راستش اصلاً نیاز به یک دانشمند و یک انسان زندانی برای این کار نیست. هر چند این آزمایش بر روی سگها انجام شده است.
اما موضوعی دیگر در جریان است. باید بدانیم که این اتفاق هر روز در بدن خود ما میافتد.
در درس اسید و باز گفته شد که روزانه بین ۵۰ تا ۱۰۰ میلیاکیوالان اسید غیرفرار در بدنمان تولید میگردد. همانند این است که ۱۰۰ میلیاکیوالان HCl را به یک انسان تزریق کنیم.
ما روزانه معمولاً به خاطر این موضوع نمیمیریم. مگر این که مکانیسمهای مقابلهای بدنمان از کار افتاده باشند. مکانیسمهایی که با تغییرات pH بدن مبارزه میکنند.
سه مکانیسم مقابلهای داریم:
۱. یکی بسیار سریع است اما محدودیتهایی نیز دارد. واضح است که نمیشود با همان سرعتی که دو صد متر را میدویم، ماراتن را بدویم. این نخستین خط دفاعی، سیستم بافری نام دارد (Buffer System). سریع اما محدود.
۲. دیگری پس از چند دقیقه به راه میافتد و تلاشش را میکند. قدرتش از اولی بیشتر است و از سومی کمتر. دومین خط دفاعی، سیستم تنفس است (Respiratory System). ششهای ما.
۳. سومی چند ساعت تا چند روز طول میکشد راه بیفتد، اما بسیار دقیق است و قدرتمند. سومین خط دفاعی ما، کلیهها هستند.
در این درس، از سیستم بافری بدن صحبت خواهیم کرد.
۲. مفهوم بافر و سیستم بافری بدن انسان
بافر هر مادهای است که بتواند به شکل برگشتپذیر به یون هیدروژن متصل شود:
H-Buffer ⇌ Buffer + H+
به بیانی دیگر، بافر مولکولی است که جایگاههایی برای یون هیدروژن دارد. برخی از این جایگاهها پر هستند و برخی خالی. هنگامی که به محیط اسید اضافه میشود، این اسید تفکیک گشته و یون هیدروژن آزاد میکند. یون هیدروژن با جایگاههای خالی واکنش نشان میدهد و در نتیجه، یونهای هیدروژن کمتری به شکل آزاد در محیط وجود خواهد داشت. معادلهی بالا به سمت چپ حرکت میکند و H-Buffer بیشتری تشکیل میگردد.
میدانیم که یونِ هیدروژنِ آزاد است که بر روی pH اثر میگذارد. همانطور که در درس مرتبط با یون هیدروژن و مفهوم pH گفته شد، تمامی این صحبتها در مورد یون هیدروژن آزاد در محیط است و نه اتم هیدروژن.
حالا فرض کن یک باز به محیط اضافه شده است. یونهای هیدروژن موجود در محیط با یون هیدروکسیل واکنش داده و غلظت هیدروژن کم میگردد. حالا از آن بافر، یون هیدروژن آزاد میگردد و معادله به سمت راست حرکت میکند.
ماجرایی که اتفاق میافتد، اصل لوشاتلیه (Le Chatelier’s Principle) است. نام دیگرش قانون تعادل است (The Equilibrium Law). به زبان ساده، اگر در یک تعادل تغییری به وجود آوریم (هر نوع استرسی)، تعادل به سمتی حرکت خواهد کرد که آن تغییر را خنثی کند.
پس بافر بر اساس اصل لوشاتلیه، تا آنجا که در توانش است، اجازه نمیدهد غلظت یون هیدروژنِ محیط تغییر کند.
بافرهای مهم بدن انسان عبارتند از:
۱. بافر فسفات که در تنظیم pH داخل سلولی و pH ادرار نقش دارد.
۲. بافر بی کربنات که در تنظیم pH خارج سلولی نقش دارد.
۳. پروتئینها که در تنظیم pH داخل سلول (مثل هموگلوبین) و خارج سلول (مثل آلبومین) نقش دارند.
۴. بافر آمونیاک که در تنظیم pH ادرار نقش دارد.
در ادامه آنها را بررسی کرده و خواهیم فهمید که چرا به چند سیستم بافری نیاز است.
برای فهمیدن بافرها باید به سراغ یکی از معروفترین معادلههای شیمی برویم: معادله هندرسون-هاسلبالخ.
۳. معادله هندرسون-هاسلبالخ (Henderson–Hasselbalch Equation)
کارل آلبرت هاسلبالخ (Karl Albert Hasselbalch) پزشک و شیمیدانی دانمارکی بود که سال ۱۸۷۴ به دنیا آمد. ما با تلفظ -َلخ مثل تلخ و بلخ آشنا هستیم. اما شاید برایمان الخ گفتن سخت بود و به همین علت نام هاسلبالخ در فارسی، به صورت هاسلباخ هم رایج شده است و عبارت معادله هندرسون هاسلباخ را در زبان گفتار زیاد میشنویم.
هاسلبالخ به همراه کریستین بور (Christian Bohr) (پدر نیلز بور، فیزیکدان معروف) از پیشگامان استفاده از pH در پزشکی بودند. او اولین کسی بود که pH خون را اندازه گرفت.
وقتی هاسلبالخ ۳۴ سالگی خود را میگذراند، لاورنس جوزف هندرسون (Lawrence Joseph Henderson) – شیمیدان و فیزیولوژیست آمریکایی – معادلهای معروف برای محاسبهی pH محیط هنگام استفاده از کربنیک اسید نوشت (نام هندرسون نیز در فارسی به شکل هندرسن یا هندرسون نوشته شده و به نظر میرسد هندرسون رایجتر است).
هشت سال بعد از چاپ معادله، یعنی سال ۱۹۱۶، هاسلبالخ معادله هندرسون را با کمک لگاریتم بازنویسی کرد و از دل این تغییر رابطه هندرسون هاسلبالخ متولد شد.

Photographs from Blood gas analysis and critical care medicine, (Henderson); and Il centenario del pH (1909 – 2009) – parte seconda. Ma era proprio necessario sostituire l’equazione di Henderson con quella di Henderson- Hasselbalch?’ (Hasselbalch).
مدرسه پزشکی معتقد است که به جای نوشتن فرمول هندرسون هاسلبالخ و حفظ کردن آن، بهتر است که ابتدا کمی در مورد مفهومی که از دل آن این معادله شکل گرفت، صحبت کنیم. زیرا که حفظ کردن این فرمول به جز برای پاسخ دادن به سؤالهای امتحان، کاربردی نخواهد داشت و باید به دنبال مفهوم پشت این معادله باشیم.
معادلهی هندرسون-هاسلبالخ زمانی استفاده میشود که یک اسید ضعیف داریم. یادمان نرود که هندرسون این معادله را برای اسید کربنیک که یک اسید ضعیف است، نوشت. پس بهتر است ببینیم منظور از اسید ضعیف چیست؟
اسید قوی اسیدی است که وقتی آن را در آب میریزیم، تقریباً به شکل کامل تفکیک میشود و یون هیدروژن (پروتون) آزاد میکند. هر اسیدی که اینگونه نباشد، اسید ضعیف نام دارد.
اسید ضعیف فرضی HA را در آب میریزیم. پس از مدتی، به یک تعادل میرسد. فرض میکنیم ۱۰۰ مولکول اسید را ریختهایم و تعادش اینگونه است که ۷۰ مولکول آن تفکیک شده و در نتیجه ۷۰ یون A و ۷۰ یون هیدروژن داریم و ۳۰ مولکول به شکل HA باقی میمانند.
برای این که بفهمیم یک اسید ضعیف چقدر تفکیک میشود، از ثابت تفکیک اسید (Acid Dissociation Constant) استفاده میکنیم. منظور از ثابت تفکیک اسید یا Ka یا ‘K، همان ثابت تعادل (Equilibrium Constant) برای معادله تفکیک اسید است.
معادلهی تفکیک اسید فرضی HA به شکل زیر است:
HA ⇌ A− + H+
با محاسبه ثابت تفکیک اسید یا همان ثابت تعادل متوجه میشویم که چقدر یون هیدروژن از این تفکیک حاصل شده است.
۳.۱. یادآوری محاسبه ثابت تعادل
اگر بخواهیم برای یک معادلهی برگشتپذیر ثابت تعادل بنویسم، نخست معادله را به شکل بالانس درآورده و موازنه میکنیم.
سپس در صورت کسر، غلظت محصولهای معادله را نوشته و در مخرج کسر، واکنشدهندهها را مینویسیم. ثابت تعادل معادلهی فوق را که Kc یا Keq یا K مینامیم، اینگونه میتوانیم محاسبه کنیم:
aA+bB⇋cC+dD
K_c=\frac{[C]^c[D]^d}{[A]^a[B]^b}
فرمول ثابت تعادل اسید
بر اساس معادلهی ثابت تعادل، برای اسید ضعیف فرضی HA ثابت تعادل را حساب میکنیم. معادلهاش بالانس است و ثابت تعادلش را که از این به بعد ثابت تفکیک اسید مینامیم، بدین شکل میتوانیم محاسبه کنیم:
K_a=\frac{[H^+][A^-]}{[HA]}
ثابت تفکیک اسید
Ka= acid dissociation constant
[A–] = concentration of the conjugate base of the acid
[H+] = concentraion of hydrogen ions
[HA] = concentraion of chemichal species HA
حالا ما چه میخواهیم؟ اصلاً چرا به سراغ این معادله رفتهایم؟
ما میخواهیم بفهمیم با توجه به این بافرهایی که در بدن داریم، pH چه تغییری میکند. میخواهیم متوجه بشویم تا بتوانیم اختلالات اسید و باز را تشخیص دهیم.
پس آنچه به دنبالش هستیم pH است و میدانیم که pH به غلظت یون هیدروژن بستگی دارد. حالا در ادامه مرحله به مرحله بررسی میکنیم که چگونه از معادلهی فوق به pH برسیم:
K_a=\frac{[H^+][A^-]}{[HA]}
معادلهی ثابت تفکیک اسید را کمی تغییر میدهیم و آن را به این شکل مینویسیم:
[H^+]=K_a\frac{[HA]}{[A^-]}
یادمان است که pH = -log[H+] بود. پس دو طرف معادله را در log- ضرب میکنیم. در درس مفهوم pH، مفهوم لگاریتم را یادآوری کردهایم.
-log[H^+]=-log(K_a\frac{[HA]}{[A^-]})
حالا لگاریتم را باز میکنیم و به جای log[H+]- عبارت pH را مینویسیم.
pH=-logK_a-log\frac{[HA]}{[A^-]}
هنوز هم میخواهیم کمی معادله را سادهتر کنیم، از این به بعد، logKa– را pK مینامیم. همانند pH که منفیِ لگاریتمِ غلظت یون هیدروژن است، pK برابر منفی لگاریتم ثابت تفکیک اسید است. مفهومش را کمی جلوتر بیشتر توضیح میدهیم. حالا معادله اینگونه میشود:
pH=pK-log\frac{[HA]}{[A^-]}
از آنجایی که کسانی که این معادله را نوشتند، منفیپسند نبودند، برای این که علامت منفی را نیز از معادله حذف کنیم، آن را در لگاریتم اعمال کرده و معادله را اینگونه مینویسیم:
pH=pK+log\frac{[A^-]}{[HA]}
معادلهای که به آن رسیدهایم، معادله هندرسون هاسلبالخ است.
پس یادمان باشد که معادلهی هندرسن هاسلبالخ برای تعیینِ pH محیطهایِ آبیِ حاویِ اسید ضعیف که همان بافر است، به کار میرود.
۴. pK چیست؟
قبل از اینکه بافر بی کربنات را بیشتر بررسی بکنیم و کاربرد معادله هندرسون هاسلبالخ را بیشتر متوجه بشویم، بهتر است که مفهوم pK را نیز روشنتر بدانیم.
در نظر بگیریم که در معادلهی هندرسون هاسلبالخ غلظت HA با غلظت A برابر است. در آن صورت معادله را میتوان اینگونه نوشت:
pH = pK + log1
میدانیم که لگاریتم یک در مبنای ده برابر صفر است. پس معادلهی نهایی این خواهد بود.
pH = pK
پس اگر بخواهیم pK را تعریف بکنیم میتوانیم اینگونه بگوییم: pK برابر با pH ای است که در آن نیمی از مولکولهای اسید ضعیف تفکیک شده و در نتیجه غلظت HA برابر با A است.
به بیان دیگر، در این pH به نیمی از مولکولها، یون هیدروژن متصل است و نیمی دیگر، جایگاهی خالی برای یون هیدروژن دارند.
علاوه بر نکتهی فوق، با بررسی معادلهی تفکیک اسید متوجه میشویم که هر چه عدد Ka بزرگتر باشد (به بیان دیگر، pKa کوچکتر باشد)، یعنی صورت کسر بزرگتر است. یعنی pKa کوچکتر، نمایانگر تمایل اسید من برای بیشتر تفکیک شدن و آزاد کردن پروتون و در نتیجه قدرت اسیدی بیشتر است.
پس یادمان باشد که pKa به ما میگوید که اسید ضعیف داریم یا قوی. pH به ما میگوید که این محیط اسیدی است یا قلیایی. ربط دارند. اما یکسان نیستند.
حالا با هم به بررسی مهمترین بافر بدن، یعنی بافر بیکربنات میپردازیم.
۵. سیستم بافر بی کربنات
بافر همانند یک جذبکنندهی ضربه و شوک است. وجود بافر، تا حدی به pH محلول پایداری میبخشد. برای این عملش، به اجزایی نیاز دارد. اجزای بافر بی کربنات دو ماده هستند.
اولین جزء کربنیک اسید (H2CO3) است که نقش اسید ضعیف را دارد. دومین نیز یک نمک بیکربنات مثلاً سدیم بیکربنات (NaHCO3) است.
کربنیک اسید از ترکیب آب و دی اکسید کربن تشکیل میشود. این واکنش برگشتپذیر در حالت عادی کند است و در صورت وجود آنزیم کربنیک انهیدراز Carbonic Anhydrase است که سرعتش زیاد میگردد. این آنزیم به مقدار فراوان در چندین قسمت از بدن وجود دارد.
کربنیک اسید تولید شده به میزان کمی تفکیک شده و مقدار کمی یون هیدروژن تولید میکند. چرا؟ چونکه یک اسید ضعیف است.
اما، نمکِ بیکربنات سدیم تقریباً به شکل کامل به یون سدیم و یون بیکربنات تفکیک میشود.
حالا تمام اجزای بافر را کنار هم میگذاریم تا تصویری کلی داشته باشیم:
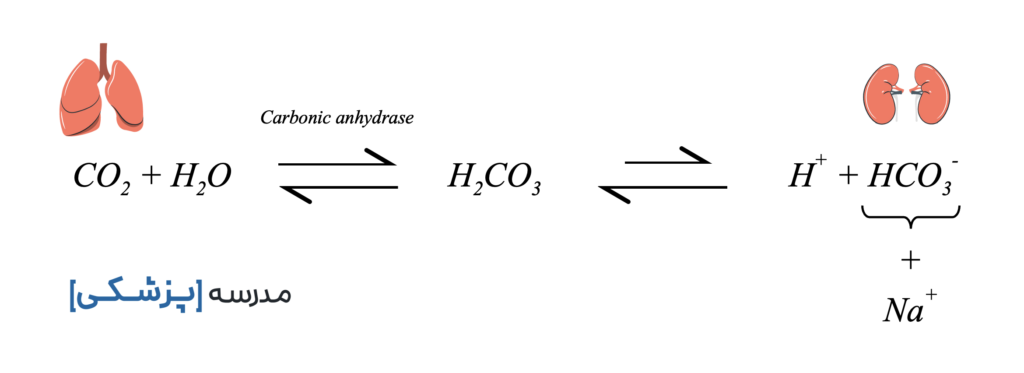
میبینیم که در یک سمت معادله گاز کربن دی اکسید وجود دارد که دفع آن توسط ریهها قابل تنظیم است. در طرف دیگر نیز بیکربنات وجود دارد که مقدار آن توسط کلیهها تنظیم میشود.
تفاوت اصلی بافر بی کربنات با دیگر بافرهای بدن در این است که هم توسط ریهها و هم توسط کلیهها تنظیم میگردد. به عبارتی، بافری است با تنظیم توسط دو ارگان که یکی از آنها یک سیستم باز (Open System) با عکسالعمل سریع است و میتواند ظرف چند دقیقه بافر را تنظیم کند. قدرت اصلی بافر بیکربنات در همین است: یک بافر با مقدار فراوان با تنظیم توسط دو ارگان که یکیشان سیستم باز است.
این بافر آنقدر مهم است که اختلالات اسید و باز را بر اساس آن نامگذاری میکنند.
اختلالاتی که حاصل تغییرات غلظت بیکربنات است، متابولیک (Metabolic Acid-Base Disorder) نام دارند. کاهش بیکربنات منجر به اسیدوز متابولیک و افزایش بیکربنات منجر به آلکالوز متابولیک میشود.
اختلالاتی را که حاصل تغییر غلظت کربن دی اکسید است، تنفسی (Respiratory Acid-Base Disorder) مینامیم. افزایش دی اکسید کربن منجر به اسیدوز تنفسی و کاهش دی اکسید کربن منجر به آلکالوز تنفسی می شود.
پیام درس و جمعبندی
بدن به سه روش از تغییر pH جلوگیری میکند:
۱. سیستم بافری
۲. ریهها
۳. کلیهها
بافرها موادیاند که قابلیت اتصال برگشتپذیر به یون هیدروژن را دارند. آنها همانند بانک هستند. پول اضافه (یون هیدروژن) را در آنها گذاشته و هنگامی که پول نداریم از آنجا برداشت میکنیم. اما میدانیم که بانکها نیز محدودیتی دارند.
مهمترین بافر بدن، بافر بیکربنات است. اهمیت آن در این است که اجزای آن هم توسط ریهها (گاز کربن دی اکسید) و هم توسط کلیهها (بیکربنات) تنظیم میگردند. اختلالات اسید و باز را نیز بر اساس آن نامگذاری میکنیم. اگر اختلال در غلظت بیکربنات باشد، متابولیک نام گرفته و اگر اختلال در غلظت دی اکسید کربن باشد، اختلالات تنفسی نامیده میشود.
چگونه آنها را تشخیص بدهیم؟ نخست باید pH و اثر بیکربنات و کربن دیاکسید را بر آن بدانیم. برای محاسبهی اینکه pH محلول ما با توجه به بافر بیکربنات و دیگر بافرها چه تغییری میکند، از معادلهی هندرسون هاسلبالخ کمک میگیریم.
این معادله است که در بالین به تشخیص اختلالات اسید و باز کمک میکند. به همین خاطر است که باید مفهوم آن را خوب درک کنیم.
تمرین
با توجه به معادلهی بافر بیکربنات، اگر یک اسید قوی/باز قوی به بدن اضافه شود، بافر بیکربنات چگونه به مقابله برمیخیزد؟ غلظت کدام یک از اجزا بیشتر و غلظت کدام کمتر میگردد؟
آنزیم کربنیک انهیدراز (Carbonic Anhydrase) دیگر در چه قسمتهایی وجود دارد؟ آن را چگونه میتوان مهار کرد؟ مهار آن در کجا کاربرد دارد؟




عالی بود امیرمحمد بعد مدتها فهمیدم که اصن این pk چی هست
عالی بود ممنون
خیلی عالی بود امیر محمد
ممنون ازت