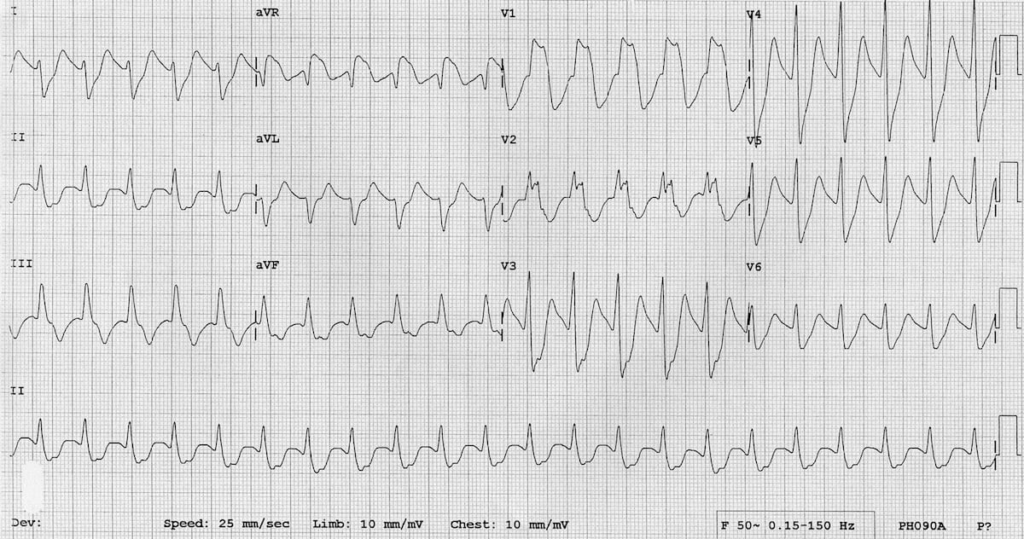
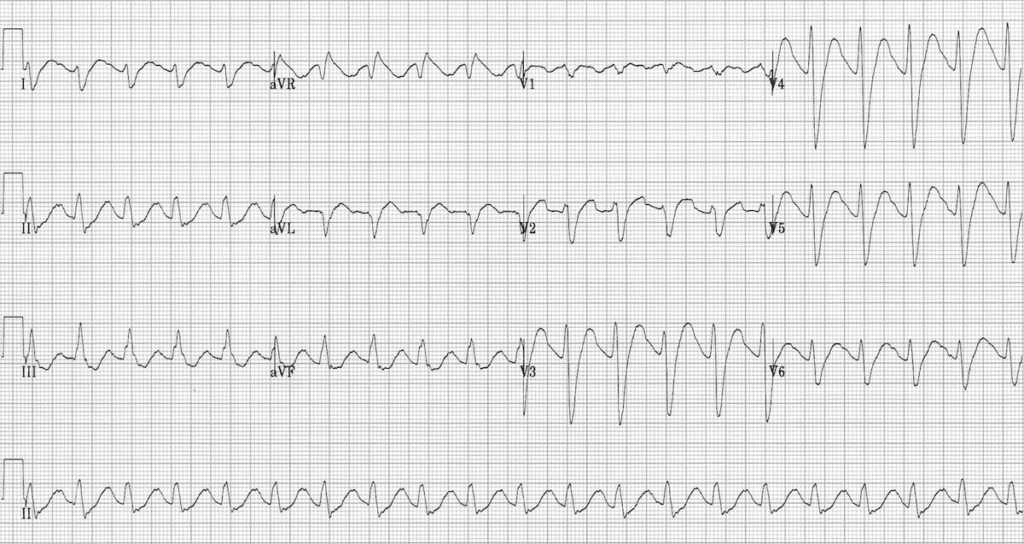
گفت: چهل عدد نورتریپتیلین خورده. دو بار تشنج کرده. ضربان قلبش ۱۲۰ تا در دقیقه و هوشیاریاش کم است. این هم نوار قلبش.
نوارش را نگاه کردم. حتی لازم نبود که به دنبال تمام نشانهها بگردم. QRS ای که پهن شده بود کاملاً به چشم میخورد.
هر لحظه احتمال داشت که یک آریتمی جدی یا تشنج مجدد داشته باشد.
دوباره نگاهش کردم. لاغر بود. شاید حدود ۵۰ کیلوگرم. سریعاً گفتم که دو ویال کوچک بیکربنات سدیم را برای او تزریق کنند.
باید منتظر نوار قلب دوم میماندم.
ماجرایی همیشگی و تکراری، اما خطرناک و جدی.

اهمیت مسمومیت با داروهای ضد افسردگی سه حلقه ای
تا همین چند سال پیش، مسمومیت با داروهایی مثل نورتریپتیلین (Nortriptyline)، آمی تریپتیلین (Amitriptyline)، ایمی پرامین (Imipramine) و کلومیپرامین (Clomipramine) در کشورمان بیداد میکرد. همانطور که سالهای قبل از آن مسمومیت با داروهایی مثل ترانیل سیپرومین و سلژیلین رایج بود.
الان چطور؟ آیا کم شده است؟
کمتر شده است. اما هنوز هم جدی و رایج است. همانطور که در درمان افسردگی، ضد افسردگی سه حلقه ای (tricyclic antidepressants or TCA) جای خود را به داروهایی مثل سرترالین و فلوکسیتین و سیتالوپرام (از مهارکنندههای انتخابی بازجذب سروتینین یا همان SSRI) دادهاند، در مسمومیت نیز جایگاهشان – کمی – کمرنگتر شده است.
اما چرا لازم است به مسمومیت با این داروها توجه ویژهای داشته باشیم؟
میتوانیم چهار علت برای آن در نظر بگیریم:
- بیمارانی که نیازمند مصرف این دسته دارویی هستند، به علت ذات بیماری خود (از قبیل افسردگی و درد مزمن) در ریسک بالاتری برای suicidal attempt هستند و مصرف بیش از اندازه (بیشمصرفی، اوردوز یا overdose) یکی از روشهای رایج این کار است.
- دوز توکسیک و سمی این دارو به دوزهای درمانی آن نزدیک است. اصطلاحاً پنجره درمانی باریکی (narrow therapeutic window) دارند. بهطوری که ۱۵۰۰ میلیگرم آمیتریپتیلین یا ایمیپرامین در بسیاری از بیماران میتواند کشنده باشد. کودکان ممکن است با دوز ۱۰۰ میلیگرم هم دچار مسمومیت شوند.
- میدانیم که تنها کاربرد این داروها در درمان افسردگی نیست. از درمان اختلالات خواب کاربرد دارند تا درمان سندرم روده تحریکپذیر و نوروپاتی و پیشگیری از سردردهای میگرنی. به عبارت دیگر، تنها علت تجویزشان مشکلات مربوط به روان نیست. به همین خاطر هنوز هم از داروهای نسبتاً رایج بوده و مسمومیت نیز با آنها دیده میشود و از مسمومیتهای شایع کشورمان – در کنار اپیوم، پروپرانولول، استامینوفن، بنزودیازپین، SSRI و متانول – هستند.
- مسمومیت با این داروها آنتیدوت مؤثر دارد و اگر آن را بشناسیم میتوانیم در عمدهی اوقات این افراد را درمان کنیم.
نکتهای که باید بر آن تأکید کنیم این است که این بیماران ممکن است در بدو مراجعه حال عمومی خوبی داشته باشند و سپس در عرض چند ساعت به سرعت بدحال شوند. این بدحالی ممکن است بدون هیچ علامت هشداری باشد و بیمار ناگهان ایست قلبی یا تنفسی بدهد یا تشنج بکند.
داستان انتخاب ترکیب G22355
سال ۲۰۰۵ بود که رولاند کوهن (Roland Kuhn)، روانپزشک سوئیسی در سن نود و سه سالگی از میان ما رفت و احتمالاً جواب چهار سؤال را نیز با خود به خاک سپرد:

چه شد که در آن هتل در زوریخ، در ملاقات معروف سال ۱۹۵۵ با نماینده شرکت داروسازی گایگی (Geigy)، از میان ۴۰ ترکیب برای درمان روانپریشی (psychosis) در بیماران اسکیزوفرنی که جلویش گذاشته بودند، ترکیب G22355 را انتخاب کرد؟
چه شد که پس از عدم پاسخ بیماران روانپریش به این ترکیب، در نخستین ماه سال ۱۹۵۶، بدون اینکه به شرکت داروسازی گایگی بگوید، G22355 را به سه بیمار مبتلا به افسردگی شدید داد؟
چه شد که پس از عدم بهبودی در چند روز اولیه، باز هم G22355 را برای آن سه بیمار ادامه داد و ناامید نشد و بالاخره در روز ششم درمان دید که پائولا، امروز صبح، انرژی بیشتری دارد و روحیهاش بهتر است و کم کم آن دو نفر دیگر نیز بهتر شدند؟
چه شد که پس از طرد شدن توسط شرکتداروسازی و جامعهی روانپزشکی در مورد توضیح او که G22355 را برای افسردگی میتوان استفاده کرد، باز هم آنقدر به حرف خود معتقد بود که برای افسردگی همسر رابرت بوهرینگر (از سهامداران گایگی)، از همین ترکیب G22355 استفاده کرد و پس از بهبود همسرش او را قانع کرد که این ترکیب را به بازار عرضه کنند؟ بوهرینگر نیز با لابیگری و نفوذی که در گایگی داشت این ترکیب را برای عرضه جهانی جلو برد. ترکیبی که آن زمان نامش را ایمی پرامین گذاشتند.
اینگونه بود که اولین TCA دنیا متولد شد.

فارماکولوژی داروهای TCA
این داروها جذب گوارشی خوب و سریعی دارند و علائم ۳۰ تا ۴۰ دقیقه بعد از مصرف میتواند شروع شود. حداکثر غلظت سرمی آنها ۲ الی ۸ ساعت بعد از مصرف ایجاد میشود. البته در مسمومیت، به علت اثر آنتی کولینرژیک، ممکن است تخلیهی معده کند شده و چند ساعت بعد علامتدار شوند.
اهمیت این کند شدن در ترخیص نکردن سریع فرد بیعلامت است؛ زیرا ممکن است دارو هنوز کامل جذب نشده باشد. همچنین اهمیت دومش در درمان بوده و باعث میشود قانون معروف دادن شارکول فعال برای این افراد صادق نباشد و بشود حتی با تأخیر شارکول داد که در قسمت تشخیص و درمان مسمومیت با ضد افسردگی سه حلقه ای به این موضوع پرداختهایم. دفع این داروها عمدتاً از طریق کبد است.
این داروها اتصال به پروتئین بالایی دارند (بالای ۹۰ درصد) و لیپوفیل هستند. این دو ویژگی باعث توزیع مولکولهای دارو در سراسر بدن میشود؛ به عبارت دیگر حجم انتشار (volume of distribution) بالایی دارند و کمتر از ۲ درصد مقدار داروی مصرف شده در داخل خون باقی میماند.
حجم انتشار بالا باعث میشود همودیالیز، هموپرفیوژن و دیالیز صفاقی، جایگاهی در درمان این مسمومیت نداشته باشد.
تعدادی از داروهای این دسته متابولیت فعال دارد (مثل آمی تریپتیلین و ایمی پرامین) و علاوه بر نیمه عمر طولانی خود داروها، متابولیتهای طولانیاثر آنها باعث تداوم علائم در موارد مسمومیت میشود. به طور مثال نیمه عمر ایمی پرامین در بزرگسالان به طور میانگین ۱۶ ساعت و نیمه عمر متابولیت فعال آن حدود ۲۴ ساعت است. این موضوع نیز اهمیت عدم ترخیص زودهنگام را گوشزد میکند.
این داروها قلیاهای ضعیفی هستند. به طوری که در pH اسیدی جزء آزاد این داروها افزایش یافته و اثرات آنها بیشتر نمایان میشود.
از نظر فارماکودینامیک، این دسته دارویی روی چندین ناقل عصبی و گیرنده به درجات مختلفی تأثیر میگذارد. آنها را که از نظر بالینی در مسمومیت با این داروها اهمیت بیشتری برایمان دارند، پررنگ کردهایم:
- مهار بازجذب پیشسیناپسی سروتونین و نوراپینفرین
- مهار کانالهای سدیمی که عامل ایجاد سمیت قلبی در مسمومیت است.
- مهار گیرنده گابا (GABA) که عامل احتمالی ایجاد تشنج در مسمومیت است.
- مهار گیرنده موسکارینی استیلکولین که علت شکایتها و نشانههای آنتیکولینرژیک این داروها است.
- مهار گیرنده آلفا ۱ سمپاتیک که عامل ایجاد هایپوتنشن وضعیتی در دوزهای درمانی و همچنین یکی از فاکتورهای دخیل در هایپوتنشن در دوزهای توکسیک است.
- مهار گیرنده هیستامینی که در ایجاد اثر سداتیو (sedative) نقش دارد.
اگر با مرور این همه اثر دچار سردرگمی شدهاید، به ابتدای درس برگردید و جملهی جفری لیبرمن را که در مورد این داروها گفته است، دوباره بخوانید.
این فرضیه وجود دارد که دو انتقال دهنده عصبی، یعنی سروتونین و نوراپینفرین، در مسیرهای بروز احساسات و خلق (mood expression) نقش دارند. بر اساس این فرضیه، کاهش این انتقال دهندههای عصبی علت اصلی در ایجاد افسردگی است.
چرا این فرضیه به وجود آمد؟ چون مشاهده کرده بودند که اکثر داروهایی که علائم افسردگی را بهبود میبخشند، عملکرد این دو ناقل عصبی را ارتقا میدهند و به نحوی سطوح این دو را در پایانههای عصبی که در خلق نقش دارند بالا میبرند. از این رو این داروها در زمان معرفی، در درمان افسردگی به کار رفتند.
جملهی جان استرمن را با هم مرور میکنیم:

اثرات دیگر این داروها مثل مهار کانالهای سدیمی، مهار گیرنده گابا، مهار گیرنده موسکارینی استیل کولین، مهار گیرنده آلفا سمپاتیک و مهار گیرنده هیستامینی، همگی مواردی است که در مسمومیت با این داروها نگرانشان هستیم و درمان ما حول کنترل سمیت ناشی از مهار آنهاست.
انواع ضد افسردگی سه حلقه ای موجود در ایران
داروهای این دسته که به طور شایع تجویز میکنیم شامل آمی تریپتیلین، نورتریپتیلین (که متابولیت فعال آمی تریپتیلین است)، ایمی پرامین، دسیپرامین (Desipramine) (که متابولیت فعال ایمی پرامین است)، کلومیپرامین و دوکسپین (Doxepin) است.
تقریباً هر کدام اگر به میزان ۱۰ الی ۲۰ میلیگرم به ازای هر کیلوگرم وزن بدن مصرف شود، به دوز تهدیدکنندهی حیات رسیده است.
از آنجایی که دوزهای درمانی آنها در افسردگی مشابه است، این دسته معمولاً به صورت قرصهای ۱۰، ۲۵ و ۵۰ میلیگرمی موجود هستند. البته آمی تریپتیلین قرصهای ۷۵ و ۱۰۰ میلیگرم نیز دارد.
در اخذ شرح حال از بیماری که اذعان به مصرف دارویی از این دسته میکند، نوع دارو و دوز کلی مصرف شده و همچنین مصرف دارو یا توکسینهای دیگر حائز اهمیت است. اثرات توکسیک همه داروهای این دسته تا حد زیادی مشابه یکدیگر است.


پاتوفیزیولوژی اثرات قلبی و تغییرات نوار قلب
اصلیترین علت مرگ در اثر مسمومیت با TCAها، به علت اثرات آن بر سیستم قلبی – عروقی با ایجاد هایپوتنشن مقاوم به درمان و انواع دیسریتمی است.
شایعترین یافته قلبی در مسمومیت با داروهای سه حلقهای، تاکیکاردی سینوسی است.
دو علت برای تاکیکاردی وجود دارد. اولی اثرات آنتیکولینرژیک TCA بوده که با مهار گیرنده موسکارینی استیل کولین ایجاد میشود و دومی تاکیکاردی رفلکسی به خاطر کاهش فشار خون است. هایپوتنشن را در ادامه توضیح خواهیم داد.
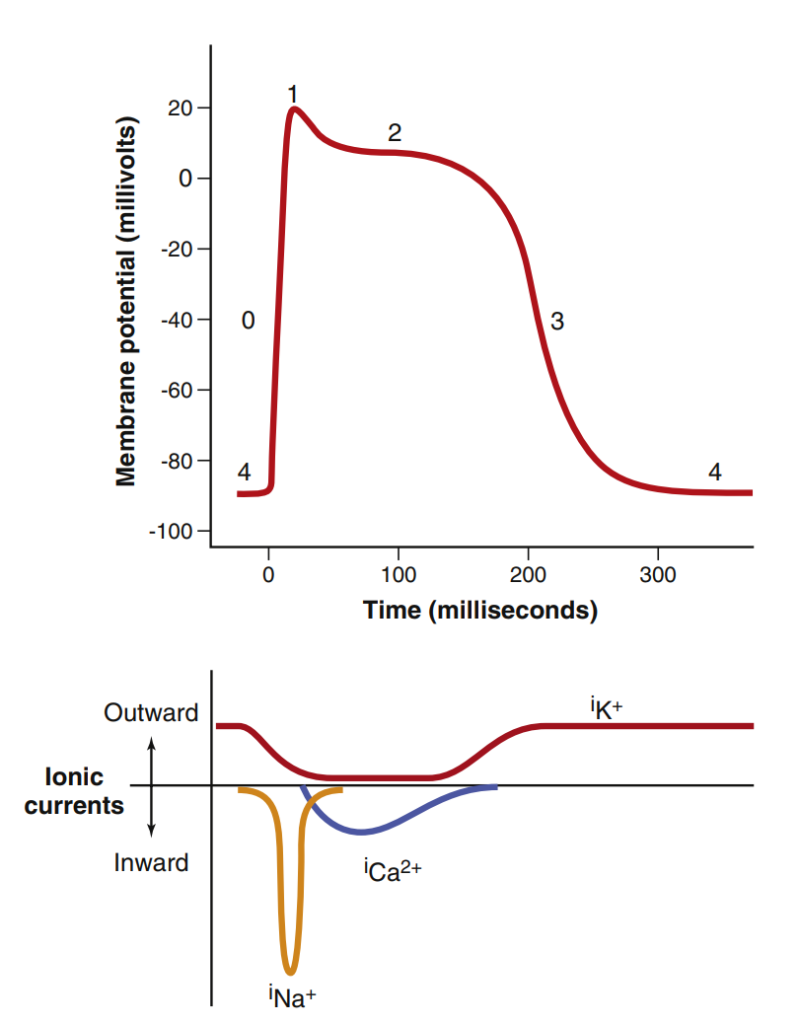
برای درک بهتر اثر قلبی و تغییرات نواری در مسمومیت با TCA بهتر است ابتدا به صورت کوتاه مراحل پتانسیل عمل بطن را با هم مرور کنیم:
پتانسیل عمل بطن (ventricular action potential) در چهار مرحله یا فاز اتفاق میافتد:
پس از رسیدن به پتانسیل آستانه، کانالهای سریع سدیمی و کانالهای آهسته کلسیمی شروع به باز شدن میکنند. کانالهای سریع، بلافاصله باز شده و سدیم از طریق کانالهای سدیمی سریع وارد سلول شده و منجر به فاز صفر یا فاز دپولاریزاسیون سریع (Phase 0) میشود. این قسمت در نوار قلب در شروع QRS رخ میدهد. هر عاملی که از ورود سریع سدیم ممانعت کند، باعث افزایش مدت زمان QRS شده و آن را پهن میکنند (مثل اثر هایپوکالمی بر روی ماهیچه قلبی).
با غیرفعال شدن (inactivation) کانالهای سدیمی سریع و باز شدن کانالهای پتاسیمی و خروج پتاسیم از سلول، فاز یک یا رپولاریزاسیون اولیه (Phase 1) اتفاق میافتد.
حالا دیگر کانالهای آهسته کلسیمی بالاخره باز میشوند و از طریق آنها سدیم و کلسیم به داخل سلول وارد شده و فاز دو یا کفه (Phase 2 or plateau) را ایجاد میکنند. این فاز را در نوار قلب به صورت قطعه ST میبینیم.
با ورود کلسیم به سلول، کانالهای پتاسیمی تاخیری نیز باز شده و همزمان یک جریان ورودی کلسیم و یک جریان خروجی پتاسیم ایجاد میشود. کمکم کانالهای کلسیمی شروع به بسته شدن میکنند و با ادامه یافتن جریان پتاسیم به بیرون سلول، فاز ۳ یا رپولاریزاسیون اتفاق میافتد (Phase 3 or Repolarization). در نوار قلب این قطعه معادل موج T است.
هر عاملی که باعث طولانی شدن یا کوتاه شدن فاز ۲ و ۳ از پتانسیل عمل شود، در نوار قلب به صورت طولانی شدن یا کوتاه شدن QT interval نمایان میشود.
در اینجا یک نکتهی دیگر نیز باید بدانیم.
اگر کل زمان فاز رپولاریزاسیون در سلولهای عضله بطن را به سه قسمت تقسیم کنیم، یکسوم ابتدایی آن سلول اصطلاحاً در دوره تحریکناپذیریِ مطلق (absolute refractory period) قرار دارد و نمیتواند پتانسیل عمل دیگری را شروع کند. دو-سوم انتهایی، دروه تحریکناپذیری نسبی (relative refractory period) است.
فاز چهار فاز استراحت سلول (Phase 4 or resting phase) است که با عملکرد پمپ سدیم پتاسیم، توزیع یونها همانند قبل میشود.
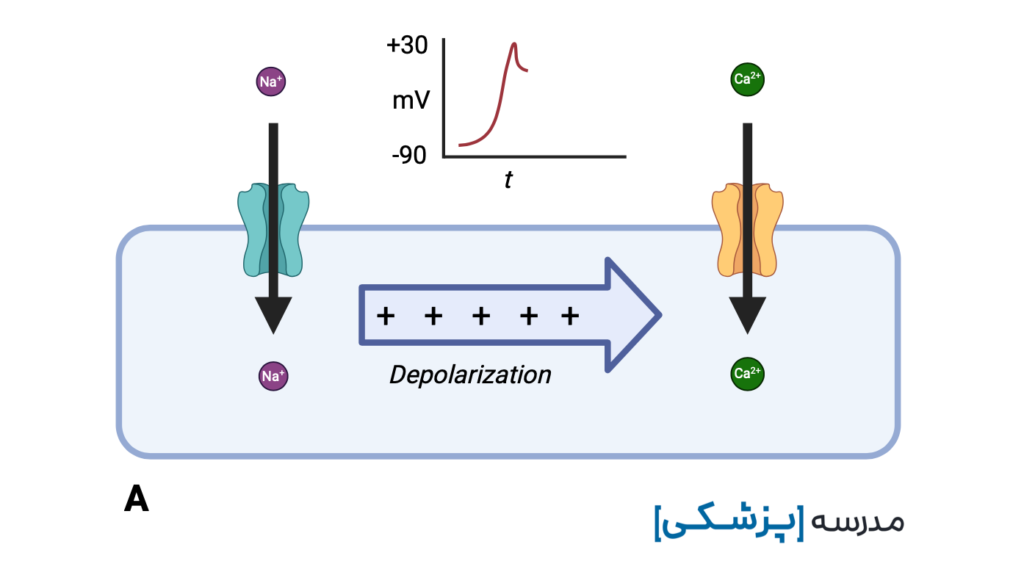
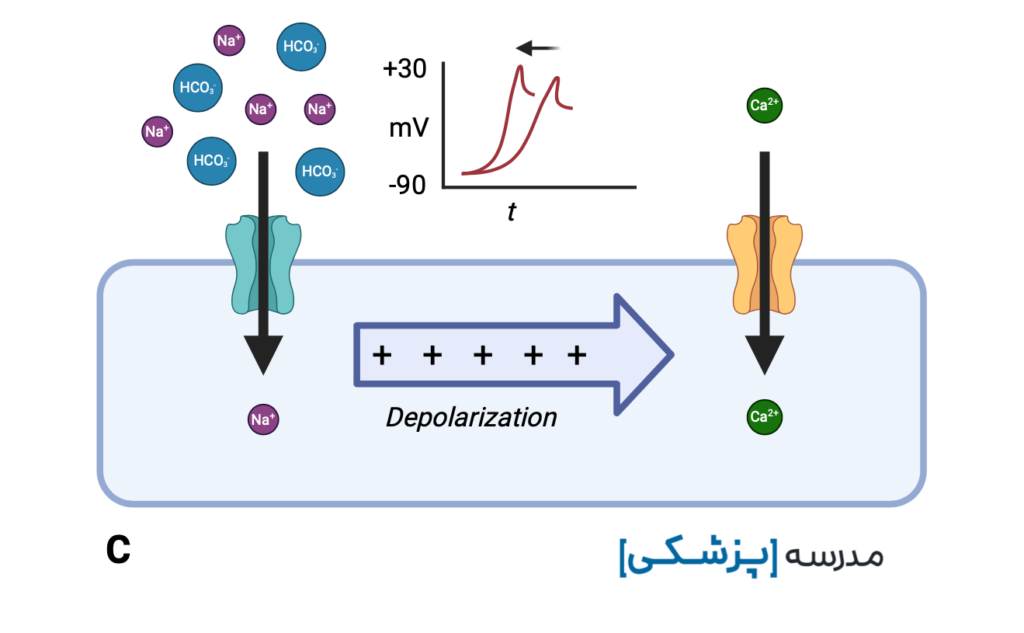
ضد افسردگی های سه حلقه ای با مهار کانالهای سدیمی سریع که مسئول فاز صفر پتانسیل عمل هستند، باعث تأخیر در ورود سدیم به سلول، خواهند شد.
این تأخیر ایجاد شده در دپولاریزاسیون بطنی (intra-ventricular conduction delay یا IVCD) خود را به صورت پهن شدن کمپلکس QRS نشان میدهد.
هر خانهی کوچک در کاغذ نوار قلب در حالت استاندارد ۴۰ میلیثانیه است. در مسمومیت با TCA عرض QRS بیشتر از ۱۰۰ میلیثانیه را پهن در نظر میگیریم، یعنی بیشتر از ۲/۵ خانهی کوچک.

شایعترین یافته در مسمومیت با TCA، تاکی کاردی سینوسی است و مهمترین یافته برای ما، پهن شدن QRS است.
علاوه بر این تأخیر در دپولاریزاسیون بطنی در مسمومیت با TCA، باعث تغییر محور کمپلکس QRS به سمت راست میشود. چرا این اتفاق میافتد؟
مهار کانالهای سدیمی سریع منجر به افزایش دورهی تحریکناپذیری مطلق میشود.
شاخهی سمت راست (right bundle branch) عموماً دوره تحریکناپذیری مطلق طولانیتری نسبت به شاخه چپ دارد. علاوه بر این نسبتاً زودتر هم تحت تاثیر اثر مهاری کانال سدیمی توسط TCA قرار میگیرد.
پس زمانی که موج دپولاریزاسیون شاخهی سمت چپ و متعاقباً میوکارد بطن چپ را تحریک میکند، شاخه سمت راست به دلیل طولانیتر شدن دوره تحریکناپذیریِ مطلق، با تأخیر دپولاریزه میشود، در نتیجه برآیند بُردار دپولاریزاسیون بطنی به سمت راست منحرف میشود.
با ایجاد این تأخیر در دپولاریزاسیون بطن راست، در مسمومیت با TCA محور کمپلکس QRS به سمت راست شیفت پیدا میکند و میتواند الگوی right bundle branch block (RBBB) را ایجاد کند. البته این الگو همیشه ایجاد نمیشود.
عکس از LITFL.
البته یافتههای حساستری برای پی بردن به وجود تاخیر در دپولاریزاسیون بطنی وجود دارد:
شیفت محور قسمت انتهایی کمپلکس QRS (۴۰ میلیثانیه آخر) به سمت راست
یا
(right-ward shift of the terminal 40-ms QRS complex axis)
توضیح این قسمت کمی دشوار است و نیاز است مباحث پایه نوار قلب در مورد محور قلب و مورفولوژی کمپلکس QRS در لیدهای مختلف را به خوبی بدانید. به وقتش و در درسهای نوار قلب مفصل به آنها خواهیم پرداخت.
اگر علاقهای ندارید میتوانید فعلاً از آن گذر کرده و مستقیماً به سراغ سه نشانهی معرفی شده برای تعیین شیفت محور QRS به سمت راست بروید و خودتان را درگیر جزئیات نکنید.
ما برای بررسی وضعیت سیستم هدایتی قلب در شرایط بالینی مختلف از نوار قلب استفاده میکنیم و این کار را با استفاده از لیدهای مختلف انجام میدهیم. شبیه این است که یک اتفاق یا فیلم را از جهتها و زوایای مختلفی فیلمبرداری میکنیم.
یکی از آن اتفاقات ویژهای که لیدهای مختلف از دید خود ثبت و ضبط میکنند، دپولاریزاسیون بطنی است. هر لید بسته به اینکه از چه زاویهای در حال ثبت دپولاریزاسیون بطنی است، مورفولوژیهای مختلفی از QRS را رسم میکند.
با توجه به جهت QRS (مثبت، منفی یا بایفازیک بودن آن)، ما محور الکتریکی قلب را تعیین میکنیم.
با توجه به قوانین بُردارها اگر بخواهیم بردار برآیند را برای نشان دادن جهت حرکت امواج دپولاریزاسیون بطنی رسم کنیم، آن بردار از سمت راست به و چپ و متمایل به apex و پشت بطن خواهد بود. چرا که بطن چپ ضخیمتر بوده و تعیین کنندهی جهت محور الکتریکی قلب است.
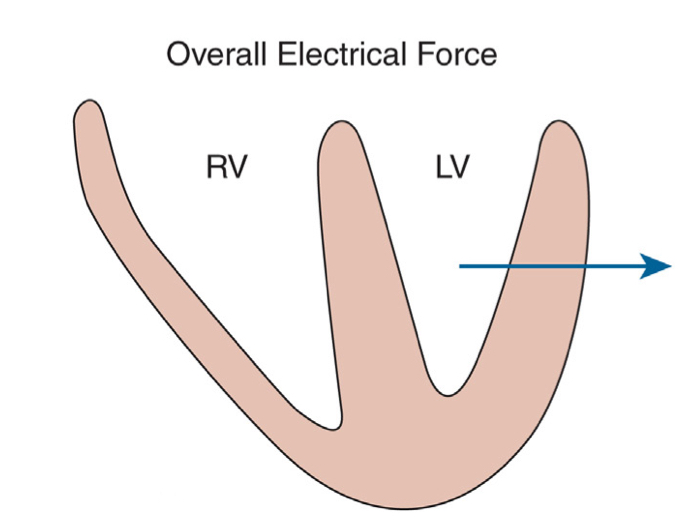
برای تعیین محور الکتریکی قلب (axis) با استفاده از نوار قلب، از ۱۲ لید مرسومی که در یک نوار قلب اخذ میشود، ما فقط از ۶ لید اندامی استفاده میکنیم که در صفحهی فرونتال هستند (یعنی لیدهای I و II و III و همچنین avR و aVL و avF). در واقع جهت محور قلب در صفحه فرونتال تعریف میشود.

با توجه به جهت لید دو که به پایین و چپ است، پس محور الکتریکی قلب به صورت تقریبی معادل جهت محور لید II اندامی و خلاف جهت محور لید aVR است.

از کتاب نوار قلب پایه گلدبرگر.
حال به درس خودمان برگردیم.
برای پیدا کردن دقیق این یافته یعنی شیفت محور قسمت انتهایی کمپلکس QRS (۴۰ میلیثانیه آخر) به سمت راست در مسمومیت با TCA، باید بُردار قسمت انتهایی QRS را در این شش لید اندامی مشخص کنیم. این بُردار در هنگام تأخیر دپولاریزاسیون بطن راست، به سمت راست انحراف پیدا میکند. دلیل این انحراف به راست را کمی بالاتر توضیح دادهایم.
موج QRS در لید aVR عمدتاً به صورت QS ثبت میشود – یعنی کاملاً منفی. گاهی با یک r کوچک ابتدایی نیز همراه است.
اگر تأخیری در دپولاریزاسیون شاخهی سمت راست ایجاد شده باشد، شاخه و بطن چپ چون کمتر و دیرتر تحت تأثیر قرار میگیرند، در ابتدا دپولاریزه میشوند. از آنجایی که جهت دپولاریزاسیون بطن چپ خلاف بُردار لید aVR است، این باعث تشکیل موج rS در قسمت ابتدایی لید aVR میشود و در قسمت انتهایی r وجود ندارد یا اینکه بسیار کوچک است.
سپس موج دپولاریزاسیون با تاخیر به شاخه راست و بطن راست میرسد و برآیند قسمت انتهایی QRS، همجهت با بُردار لید aVR میشود. و به همین دلیل در قسمت انتهایی QRS در لید aVR که نهایتاً به صورت r کوچک انتهایی بود، ارتفاعش بیشتر شده و موج R بزرگ در انتها ثبت میشود.
پس در صورت تأخیر در دپولاریزاسیون در شاخهی راست، در لید aVR که همیشه موج rS با یک r کوچک ابتدایی یا موج QS ثبت میشد، هماکنون یک موج rSR با یک R بلند انتهایی یا موج QR ثبت میشود. به عبارت دیگر، terminal R خواهیم داشت.
آنچه که اهمیت دارد، terminal R است و نه initial R.
در شکل زیر از کتاب توکسیکولوژی گلدفرانک، میتوانید این تغییرات را به خوبی ببینید:
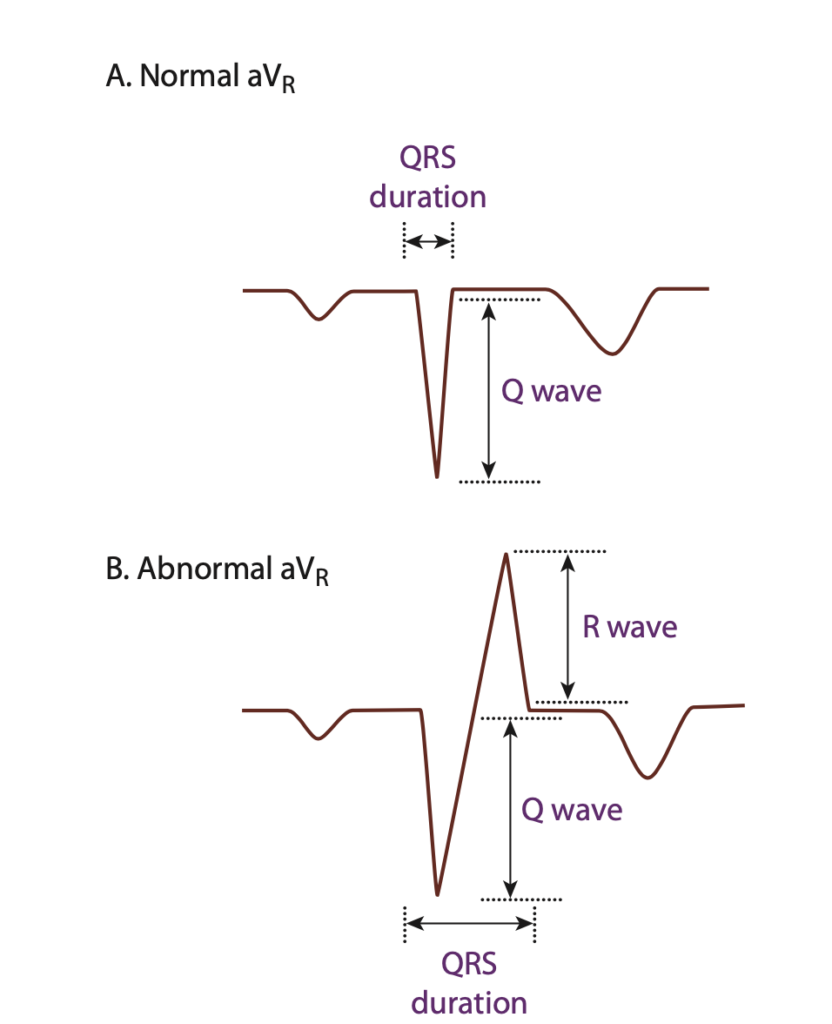
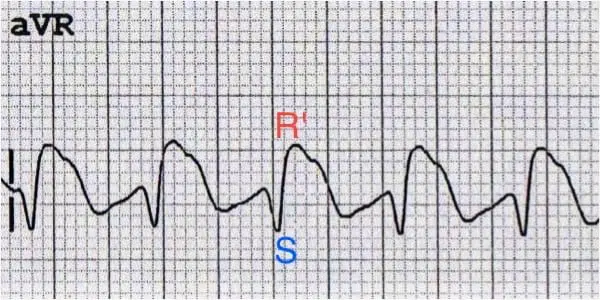
(عکس از LITFL)
در لید I و aVL (اصطلاحاً لیدهای lateral) اتفاقات معکوسی رخ میدهد و terminal R در لید aVR در اینجا به صورت slurred S دیده میشود. علت slurred S نیز همان تأخیر دپولاریزاسیون در شاخه سمت راست (RBBB یا IVCD) است، اما از دیدِ دوربین لید I و aVL.
منظور از slurred S یعنی S با شیب و سرعت کمتری به سمت خط isoelectric برمیگردد. شاید بتوانیم در این جا بگوییم یک S خسته و کند. نه یک S تیز.
(عکس از LITFL).
برای تعیین شیفت محور قسمت انتهایی کمپلکس QRS (۴۰ میلیثانیه آخر) به سمت راست از سه نشانهی زیر استفاده میکنیم:
- slurred S در لیدهای I و aVL
- وجود R انتهایی در لید aVR با هر یک از مشخصههای زیر:
- ارتفاع R بیشتر از ۳ میلیمتر باشد
- نسبت ارتفاع R به S بیشتر ۰/۷ باشد (R:S ratio > 0.7).
این تغییرات نواری چه کمکی به ما میکنند؟
علاوه بر این که وجود این تغییرات در نحوه درمان و مدیریت بیمار مسموم بسیار کلیدی و مهم هستند، با احتمال ایجاد تشنج در فرد نیز همراهی دارند.
درواقع هر کدام از سه نشانهی (۱) عرض QRS بیشتر از ۱۰۰ میلیثانیه، (۲) R انتهایی در aVR بیشتر از ۳ میلیمتر باشد یا (۳) نسبت R به S در aVR بیشتر از ۰/۷ وجود داشته باشد، فرد مستعد تشنج است. با این حال این نشانهها از یک مطالعهی کوهورت به دست آمدهاند و نمیتوان به صورت مطلق گفت که این نشانهها در تمام بیمارانی که با TCA مسموم شدهاند، دیده میشود.
همچنین اگر QRS بیشتر از ۱۶۰ میلیثانیه یا ۴ خانهی کوچک شود، فرد مستعد دیسریتمیهای کشندهی بطنی است.
در موارد مسمومیت شدید، wide QRS complex tachycardia ایجاد میشود. این تاکی کاردی به همراه QRS پهن میتواند تاکیکاردی با منشأ بطنی (مثل VT) باشد یا اینکه تاکیکاردی سینوسی همراه با اختلال هدایتی قلب (aberrancy) باشد یعنی مثلاً تاکیکاردی سینوسی به همراه بلوک شاخهای راست (RBBB).
آیا افتراق این که تاکیکاردی با منشا بطنی است یا این که سینوسی همراه با aberrancy است در فرد مسموم با TCA مهم است؟ خیر. زیرا که درمان هر دو سدیم بیکربنات است. پس نگران نیستیم که نتوانیم بگوییم کدامشان است.
اگر قرار باشد که فقط یک یافته در مورد نوار قلب بیماران TCA poisoning بدانیم، بیشک QRS widening است.
یافتههای دیگری هم ممکن است ببینیم.
درگیریهای دیگر مثل الگوی بروگادا نیز ممکن است دیده شود. مخصوصاً تیپ یک.
سندرم بروگادا در نتیجه تغییرات ساختاری در کانالهای سدیمی سریع رخ میدهد که منجر به اختلال عملکرد آن میشود و تغییراتی شبیه به مصرف ضد افسردگیهای سه حلقهای ایجاد میکند.
در الگوی بروگادا نوع یک، coved ST-segment elevation به اندازهی ۲ میلیمتر و یا بزرگتر در بیشتر از یک لید از لیدهای V1-V3 میبینیم. این ST elevation در ادامه به موج T منفی ختم میشود.
منظور از coved ST یعنی یک قطعه ST با upwardly oriented convexity. یک قطعه ST که محدب است و تحدب آن رو به بالا.

طولانی شدن QT-interval هم در دوزهای درمانی و هم در مسمومیت با TCA ایجاد ممکن است ایجاد شود.
معمولاً طولانی شدن QT interval درنتیجه تأ/خیر در رپولاریزاسیون است. اما در زمینه مصرف TCA، این تأخیر در رپولاریزاسیون در زمینه طولانی شدن دپولاریزاسیون و متعاقب به پهن شدن موج QRS است. نه اینکه واقعاً رپولاریزاسیون مختل شده باشد.

پاتوفیزیولوژی هایپوتنشن
کاهش قدرت انقباض قلب همراه با مهار گیرندههای آلفا ۱ سمپاتیک، علت اصلی ایجاد هایپوتنشن در مسمومیت با این داروها هستند.
این کاهش قدرت عضلانی قلب از اثرات مستقیم ضد افسردگی های سه حلقه ای است و در نتیجهی مهار کانالهای سدیمی سریع اتفاق میافتد. با مهار کانالهای سدیمی، اتفاقات بعدی که منجر به انقباض بطن (excitation- contraction coupling) میشوند، مختل میشود.
گیرندههای سمپاتیک در عروق بارها باعث سردرگمی افراد شده است. درست است که ما برای درمان فشار خون بالا، از داروهای بتا بلوکر استفاده میکنیم؛ اما این اثر به خاطر مهار گیرندههای بتا در عروق نیست.
سرخرگهای ما هم گیرندهی آلفا دارند و هم بتا. تحریک گیرندهی آلفا در سرخرگ منجر به تنگ شدن آنها و تحریک گیرندهی بتا در آنها، منجر به گشادی میشود. به همین خاطر است که در رینود و peripheral arterial disease استفاده از بتا بلوکر ممنوع است؛ زیرا بتا مهار شده و نور اپینفرین تماماً به آلفا متصل میشود و عروق تنگ خواهد شد و بیماری، بدتر.
پس در مسمومیت با TCA که نقش آلفا بلوکری دارد، هایپوتنشن رخ میدهد.
سمیت دستگاه عصبی مرکزی
ممکن است در زمینه در زمینه اثرات آنتیهیستامینی وضعیت هوشیاری بیمار تغییر کند و بیمار sedate شود.
بدترین حالت نیز تشنج است. مجموعهای از علل دخیل هستند. مهار گابا توسط TCAها، آستانهی تشنج را پایین میآورد و همچنین افزایش ناقلهای عصبی مثل نور اپی نفروین و سروتونین در پایانهی عصبی نیز میتواند به عنوان عامل محرک باشد.
تشنج اغلب مدت کوتاهی طول کشیده و در یک تا دو ساعت اول مصرف دارو ایجاد میشود. ممکن است هایپوتنشن و دیسریتمی در حین تشنج و یا اندکی پس از آن بروز پیدا کند. علتش احتمالاً اسیدوزی است که به خاطر تشنج ایجاد شده است.
حتماً باید مراقب دیسریتمیهای قلبی به عنوان علت ناگهانی کاهش هشیاری به همراه حرکات متناوب اندامها باشیم. میدانیم که ممکن است چنین علامتهایی ایجاد کند و در تشخیص افتراقی تشنج قرار میگیرد.
پس اگر تشنج دیدیم، وضعیت قلب را بررسی کنیم. ممکن است علت حرکات شبهتشنجی باشد. همچنین ممکن است پس از تشنج، نوار قلب تغییرات جدید داشته باشد.
سایر یافتههای مربوط به سمیت CNS این داروها شامل دلیریوم، آژیتاسیون و حتی توهم و سایکوز است. دلیریوم در زمینه اثرات آنتیکولینرژیک کمتر شایع است.
اثرات آنتی کولینرژیک و سایر یافتهها
اثرات آنتیکولینرژیک این داروها ممکن است دیده شود.
مردمکهای گشاد با پاسخ ضعیف به نور، خشکی دهان، فلاشینگ، خشکی پوست، احتباس ادراری و ایلئوس از جمله یافتههایی است که ممکن است در مسمومیت با TCA دیده شود؛ هرچند نبودن آنها ردکننده نیست.
عوارض ریوی مسمومیت با این داروها شامل ARDS و پنومونی آسپیراسیون است که به ترتیب در زمینه هایپوتنشن و افت هوشیاری/تشنج بیمار ایجاد میشود.
حتی عوارض نادری مثل ایسکمی روده – احتمالا در زمینه هایپوتنشن – و انسداد عملکردی روده – احتمالاً در زمینه اثر آنتیکولینرژیک – گزارش شده است.
پیام درس
مسمومیت با ضد افسردگیهای سه حلقهای از چند جهت اهمیت دارد. اول وجود بیماریهای همزمانی که احتمال suicide را در افراد مصرفکننده بالا میبرد. دوم پنجرهی درمانی نزدیک به دوز سمی دارو. سوم کاربردهای متعدد دیگر مثل سندرم روده تحریکپذیر یا پیشگیری از میگرن. چهارم وجود آنتیدوت مؤثر که استفادهی صحیح از مرگ و میر جلوگیری میکند.
حواسمان باشد بیمار را سریع ترخیص نکنیم. ممکن است جذب دارو با تأخیر صورت بگیرد و همچنین بعضی از علائم خود را به صورت تأخیری نشان میدهند.
سه دسته عمده از نشانهها در مسمومیت جدی با TCA قابل انتظار است: قلبی – عروقی، سیستم عصبی مرکزی و عوارض آنتی کولینرژیک.
شایعترین علامت قلبی تاکیکاردی سینوسی است که به علت اثرات آنتیکولینرژیک و ثانویه به هایپوتنشن وضعیتی ایجاد میشود.
مسمومیت قلبی و تغییرات نوار قلب در نتیجه مهار کانالهای سدیمی سریع رخ میدهد که به صورت تأخیر در دپولاریزاسیون بطن راست و ایجاد RBBB و IVCD ظاهر میشود. مهمترین یافته مسمومیت با TCA در قلب، به همین خاطر است و در نوار قلب به شکل QRS پهن (بیش از دو و نیم خانه کوچک) دیده میشود.
برای تعیین شیفت محور قسمت انتهایی کمپلکس QRS (۴۰ میلیثانیه آخر) به سمت راست از سه نشانهی زیر استفاده میکنیم:
- slurred S در لیدهای I و aVL
- وجود R انتهایی در لید aVR با هر یک از مشخصههای زیر:
- ارتفاع R بیشتر از ۳ میلیمتر باشد
- نسبت ارتفاع R به S بیشتر ۰/۷ باشد (R:S ratio > 0.7).
این یافتهها با احتمال بروز تشنج همراه هستند.
یادمان باشد شایعترین علت wide QRS complex tachycardia در مسمومیت TCA، تاکیکاردی سینوسی به همراه aberrancy ایجاد شده ناشی از بلوک شاخهای راست است. اما میتواند در نتیجهی ventricular tachycardia نیز باشد.
خودمان را درگیر افتراق این دو نکنیم چون کمکی نمیکند. درمان هر دو تزریق سدیم بیکربنات است.
حواسمان به عوارض CNS مثل تشنج و sedation باشد. اگر بیمار حرکات شبیه تشنج دارد، حتماً باید دیسریتمیهای قلبی را به عنوان علت ناگهانی کاهش هشیاری به همراه حرکات متناوب اندامها در نظر داشته باشیم.
تمرین
به نظر شما بدترین یافته که میتوان در نوار قلب بیمار با TCA poisoning دید چیست؟